下列说法正确的是:( )
A.在100 ℃.101 kPa条件下,液态水的气化热为40.69 kJ·mol-1,则H2O(g) H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 H2O(l) 的ΔH ="+" 40.69 kJ·mol-1 |
| B.已知MgCO3的Ksp = 6.82 × 10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+) = c(CO32-),且c(Mg2+) · c(CO32-)= 6.82 × 10-6 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小 |
| D.已知: |
| 共价键 |
C-C |
C=C |
C-H |
H-H |
| 键能/ kJ·mol-1 |
348 |
610 |
413 |
436 |
则可以计算出反应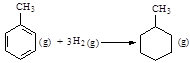 的ΔH为-384 kJ·mol-1
的ΔH为-384 kJ·mol-1
下列说法中错误的是( )
| A.绝大多数的非金属元素都分布在p区 |
| B.元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C.除氦以外的稀有气体原子的最外层电子数都是8 |
| D.同一元素的各种同位素的物理性质、化学性质均相同 |
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A.XYZ2 | B.X2YZ3 | C.X2YZ2 | D.XYZ3 |
下列粒子属于等电子体的是
| A.CH4和NH4+ | B.NO和O2 |
| C.NH2-和H3O+ | D.HCl和H2O |
下列共价化合物中,共价键的键能最大的是
| A.HCl | B.HF | C.HBr | D.HI |
下列说法中正确的是
| A.双原子分子中化学键键能越大,分子越牢固 |
| B.双原子分子中化学键键长越长,分子越牢固 |
| C.双原子分子中化学键键角越大,分子越牢固 |
| D.同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同 |