在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1)基态Ga原子的电子排布式可表示为 ;
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为 ,其中N原子的杂化类型为 ;在1 mol 5-氨基四唑中含有的σ键的数目为 。
(3)叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
工业上制备BaCl2的工艺流程图如下: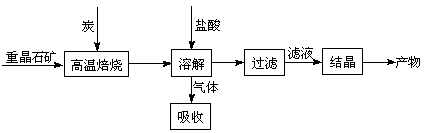
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s)△H1 =+571.2 kJ·mol-1①
4CO(g) + BaS(s)△H1 =+571.2 kJ·mol-1①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s)△H2=+226.2 kJ·mol-1②
2CO2(g) + BaS(s)△H2=+226.2 kJ·mol-1②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: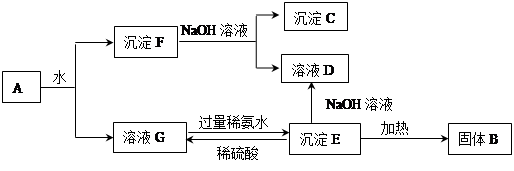
据此回答下列问题:
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D 三种物质的化学式为:B_________ C_________ D_________
(3)沉淀E与稀硫酸反应的离子方程式为________________________________________。
(4)将沉淀F中存在的两种金属元素组成的合金溶于100 mL 4mol/LHCl溶液中,然后再滴加1 mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
已知V1=160mL。根据以上信息回答:
①_________(填“能”或“不能”)计算出V3
②V2为_________mL(若能算出具体数字,请在横线上填写具体数字;若不能请在横线上填“不能确定”)
Ⅰ.实验室需配制500mL 0.2mol/L NaCl溶液
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是。
(2)配制时,需称取NaCl的质量是g
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是。(选填序号)
①没有洗涤烧杯和玻璃棒
②加蒸馏水时,不慎超过了刻度,取出少量水使液面恰好到刻度线
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视标线
⑤定容时俯视标线
Ⅱ.某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:;
假设3:催化剂中铁元素既有+3价又有+2价
(2)设计实验方案。
(3)根据(2)的实验方案进行实验:
步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设成立;若出现血红色,则假设1或3成立;
步骤4:为了进一步确定步骤3中是假设1还是假设3成立:另取A溶液于试管,加入KMnO4溶液,振荡,若出现现象,则假设1成立;反之,则假设3成立。
(4)反思
某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论。请判断该结论是否合理
(填“合理”或“不合理”)。
A、B、C、D四种可溶性盐,分别由Na+、Ba2+、Cu2+、Ag+、CO32—、SO42—、Cl—、NO3—中的不同阳离子和阴离子各一种组成。现做以下实验:
① 将四种盐各取少量,分别溶于盛有5 mL蒸馏水的四支试管中,只有B盐溶液呈蓝色。
② 分别向4支试管中加入2 mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
根据上述事实,推断这四种盐的化学式分别为:
A B C D
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。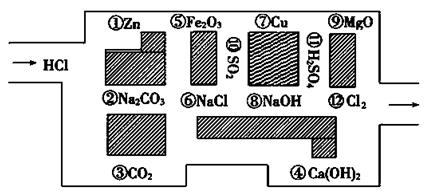
请根据要求在下列横线上填上合适的序号
(1)在迷宫中不能与稀盐酸反应的物质:属于电解质的是_______________,属于非电解质的是______________。
(2)在迷宫中的物质,能与稀盐酸发生氧化还原反应的是
(3)请你帮助它走出迷宫HCl——___—____—____—___—