下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 ,需要加热的仪器装置有 (填代号),m中反应的化学方程式为: 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,按A→G→E→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有 。
②实验中观察到E内有红棕色气体出现,证明氨气具有 性。
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。
提供的试剂:研细的钙片粉末(钙片中的其他成分不与盐酸反应)、2mol/L 盐酸、5%NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液和蒸馏水。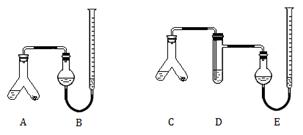
图1图2
实验过程:
I.检查两套装置的气密性。
II.在A、C的右边加入0.25 g钙片粉末,左边加入3 mL 2mol/L盐酸,塞紧塞子。在B、E中均加入饱和NaHCO3溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得 B中收集到的气体为41.90 mL,E中收集到的气体体积为39.20 mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)I中检查图1装置气密性的方法是。
(2)A中发生反应的离子方程式为;D中加入的试剂为。
(3)实验前左右两管液面在同一水平面上,最后读数时右管的液面高于左管的液面,
应进行的操作是。
(4)图2实验所得钙片中的碳酸钙的质量分数为;图1实验比图2实验所得钙片中的碳酸钙含量偏高,用离子方程式表示偏高的原因:。
实验室需要用0.1mol/LNaOH溶液450mL,根据溶液配制和使用回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:
。
(2)根据计算得知,所需称量的NaOH的质量为g。
(3)下列操作对所配浓度有何影响(填写字母)偏大的有。
| A.称量用了生锈的砝码 |
| B.将NaOH放在纸张上称量 |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 |
| D.往容量瓶转移时,有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(共10分)如图,在试管a中先加入2mL95%的乙醇,边摇动边缓缓加入5mL浓H2SO4并充分摇匀,冷却后再加入2g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液。连接好装置,用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
(1)写出a试管中的主要化学反应的方程式;
(2)加入浓H2SO4的目的是。
(3)试管b中观察到的现象是。
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用是。
(5)饱和Na2CO3溶液的作用是。
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如下图。
(2)请根据上图实验①曲线,计算降解反应在50~150s内的平均反应速率;
v(p—CP)= mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,该降解反应速率增大。但温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
(4)实验③得出的结论是:pH等于10时,
[思考与交流](5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空: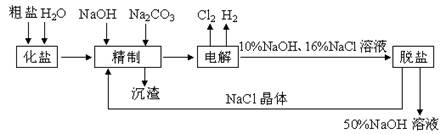
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________,与电源负极相连的电极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为_________
_______________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过_________、冷却、_________(填写操作名称)除去NaCl。