Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1) 完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
|
|
|
| ③ |
|
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如下图。
(2) 请根据上图实验①曲线,计算降解反应在50~150s内的平均反应速率;
v(p—CP)= mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,该降解反应速率增大。但温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:
(4)实验③得出的结论是:pH等于10时,
[思考与交流](5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(12分)
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)如何检查装置A的气密性
(2)为了安全,在点燃D处的酒精灯之前,在b处必须。
(3)装置B的作用是
装置C中装的液体是
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生的化学反应方程式是
(5)若FeO和Fe2O3固体混合物的质量为23. 2g,反应完全后,U型管的质量增加7.2g则混合物中Fe2O3的质量为_。
(10分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: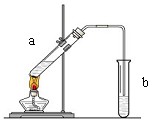
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(3)浓硫酸的作用是:①;②。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题: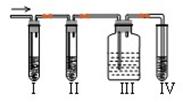
(1)实验室制备乙烯的反应方程式是:
(2)I、II、III、IV装置可盛放的试剂是I;II;III;IV。(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(3)能说明SO2气体存在的现象是。
(4)使用装置II的目的是。
(5)使用装置III的目的是。
(6)确定含有乙烯的现象是。
(1)下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。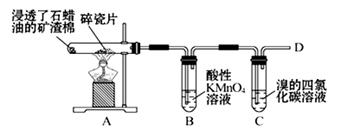
①A中碎瓷片的作用是。
②B中反应类型是。C中实验现象是。(2)制取氯乙烷(CH3CH2Cl)的最佳方法是(用化学方程式表示):;(3)用空气吹溴水到SO2溶液中的化学方程式:;(4)把干海带放在(仪器的名称)中灼烧。灼烧后的海带溶于水中,过滤后的滤液中酸化后加过氧化氢的离子方程式
(5)在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置制取乙酸乙酯。
①试管B中盛放饱和Na2CO3溶液的作用是:中和乙酸、溶解乙醇和。
②实验完成后,若要分离B中的液体混合物,需要用到的玻璃仪器主要是。
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)