某学生设计了一个制取氢氧化亚铁的最佳实验方案,实验装置见图,请分析实验过程:
⑴在B试管中加入NaOH溶液后加热煮沸1—2分
钟立即加入2mL液体石蜡,该操作目的是_______________ ________。
⑵在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量_________________________。
⑶连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为____________________,原因是_______ 。B试管中现象为__ 。
滴定实验是中学常用的定量实验,主要原理是利用已知浓度的某溶液滴加到未知浓度的溶液中,通过恰好完全反应的“终点”的判断,实验测出消耗的两种物质的量来计算未知浓度的溶液的浓度。
下面是甲同学用滴定实验来测定食用精制盐中的碘含量(食盐中加入一定量的KIO3)。
已知:I2+2S2O32-=2 I-+S4O62-,其步骤为:
A.准确称取w g食盐,加适量蒸馏水使其完全溶解;
B.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
C.以淀粉为指示剂,逐滴加入物质的量浓度为2.000×10-3 mol/L的Na2S2O3溶液15.00 mL,恰好反应完全。
(1)配平化学方程式 KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)判断c中反应恰好完全依据的现象是:当滴加最后一滴Na2S2O3溶液后,溶液由 色变为 色,且颜色半分钟内不改变 。
(3)根据以上实验,所测精制食盐中的碘含量是 mg/kg。(以含w的代数式表示)
(4)已知在酸性环境下:2H+ + S2O32- =" S↓" + SO2 ↑+ H2O,所以乙同学认为在c操作前应 ,否则实验测得食盐中碘的含量会 (填“偏高”或“偏低”或“没有影响”)
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4- + 5H2C2O4+ 6H+=2Mn2+ +10CO2+8H2O)
甲组:利用右图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。(实验中所用KMnO4溶液均已加入H2SO4)
| 序号 |
A溶液 |
B溶液 |
| ① |
2ml 0.2mol/LH2C2O4溶液 |
4ml 0.01mol/LKMnO4溶液 |
| ② |
2ml 0.1mol/LH2C2O4溶液 |
4ml 0.01mol/LKMnO4溶液 |
| ③ |
2ml 0.2mol/LH2C2O4溶液 |
4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究 对化学反应速率的影响。
(2)分液漏斗中A溶液应该 加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是 。
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率
为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 |
1 |
2 |
3 |
4 |
| 水/ml |
10 |
5 |
0 |
X |
| 0.5 mol/L H2C2O4/ml |
5 |
10 |
10 |
5 |
| 0.2 mol/L KMnO4/ml |
5 |
5 |
10 |
10 |
| 时间/s |
40 |
20 |
10 |
--- |
(4)X=
A.5B.10C.15D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是 。
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)试剂X的化学式为: ,试剂Y的化学式为: ,操作Z的名称: 。
(2)判断试剂X已过量的方法是
(3)第④步中,有关的离子方程式是 。
(4)下列仪器中,蒸发结晶时会用到的是 (写仪器名称)



(5)为检验精盐纯度,需配制1000mL 0.2 mol/L NaCl(精盐)溶液,回答下列问题:
①人们常将配制过程简述为以下各步骤:A冷却;B称量;C洗涤;D定容;E溶解;F摇匀;G转移;H装瓶。其正确的操作顺序应是_______ (填序号)。
| A.B E F G C G D H A | B.B E G A C G F D H |
| C.B E A G C G D F H | D.B E A G C G D H F |
②若定容时,仰视,会造成所配制的溶液浓度(填“偏高”或“偏低”) 。
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________.
(2)烧杯间填满碎纸条的作用是__________.
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量___________________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由_______ _.
(5)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________;(填“偏大”、“偏小”、“无影响”).
某研究性学习小组在实验室模拟工业“侯氏制碱法”原理制取NaHCO3。下图是该学习小组进行模拟实验时所用到的主要装置。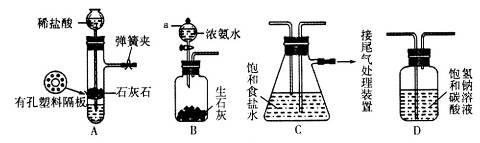
请回答下列问题:
(1)B装置中仪器a的名称是______________。
(2)C装置中发生的现象是_____________,反应的化学方程式是___________________。
(3)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,向漏斗里注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若__________________________________________.说明装置不漏气。
(4)D是连接在装置A与装置C之间的气体净化装置,装置D的作用是____________________________。
(5)实验时向饱和NaCl溶液中先通入NH3,再通入CO2的原因是__________________________________。
(6)设计实验方案,检验NaHCO3产品中是否含有氯化钠_________________________________________。