(7分)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂。
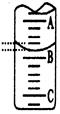
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不用化简):C1= mol/L。
某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题:
(1)试管a中反应的化学方程式: 。
(2)试管b中盛放的试剂是。
(3)实验时混合乙醇和浓硫酸的方法是
(4)甲装置试管b中导管未伸入液面下的原因是;乙装置中球形干燥管的作用是 ①②③。
(5)试管b中溶液的主要用途是:
(1)现有以下有机物:(用序号回答下列各问)
①  ②
②  ③
③  ④
④ 
①能与 溶液反应的有_________________;
溶液反应的有_________________;
②能与银氨溶液反应产生银镜的是____________________;
③既能发生消去反应,又能发生酯化反应的有___________________;
④核磁共振氢谱图中有3个吸收峰,面积比为3:2:1的是___________;
(2).为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内。
| Ⅰ 除杂实验 |
Ⅱ 试剂 |
Ⅲ 操作方法 |
答案 |
||
| Ⅰ |
Ⅱ |
Ⅲ |
|||
| ①苯(苯酚) |
A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO |
a.蒸馏 b.分液 c.盐析、过滤 d.萃取 |
① |
||
| ②乙醇(水) |
② |
||||
| ③肥皂(甘油、水) |
③ |
||||
| ④乙酸乙酯(乙酸) |
④ |
(3)a.在洁净的试管中加入少量硝酸银溶液,再逐滴滴加稀氨水,现象是先生成白色沉淀,反应的离子方程式是①_______________________ ;继续滴加至沉淀恰好溶解,即得银氨溶液,反应的离子方程式为②______________________;
b. 向a中所得的银氨溶液中滴入少量葡萄糖溶液,混合均匀后,放在水浴中加热3min~5min,即可在试管内壁上形成银镜,则此反应的化学方程式为③(葡萄糖的结构简式用G-CHO表示):
某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:
【实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体。
(1)该小组作出此推测的理由是:。
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2 mol/L的H2C2O4标准溶液、0.1 mol/L的酸性KMnO4标准溶液、酸碱指示剂。
b.实验装置设计及组装(加热及夹持装置均已略去)
【实验过程及数据处理】
(2)B中发生反应的离子方程式为:。
(3)实验前先通入一段时间的N2,其目的是。
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是
。
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25 mL,用H2C2O4标准溶液进行滴定。①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平。
( )H2C2O4+( )MnO4- +( )H+ =( )Mn2+ +( ) H2O+( ) ( )
②滴定达到终点时的现象是。
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63 mL,则铁与浓硫酸反应产生的SO2气体的物质的量为;经称量,实验前后装置D的质量减少0.8 g,则产生的气体中SO2的体积分数为。
(共10分) 某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)、按照甲同学的观点,发生反应的离子方程式为 。
两同学利用下图所示装置进行测定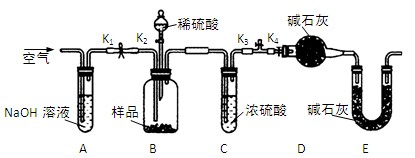
(2)、在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
(3)、装置E中碱石灰的作用是 。
(4)、实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) ;
若未进行步骤 ,将使测量结果偏低。
(5)、若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuCO3的质量分数为 。
(6)、丙同学认为还可以通过测量 来测定沉淀中CuCO3的质量分数。
(本题共12分)海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料。
(1).实验室里常用NaCl制取HCl。请在下图中选择合适的仪器用于发生HCl气体:
(填写仪器编号)。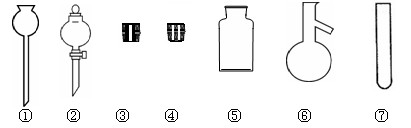
(2).在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是。
(3).产生上述现象的原因是 。
(4).收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是: 。
(5).除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要 (填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性。
(6).工业上可用食盐作为一种主要原料,经不同的方法生产纯碱。联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是: 、 和避免产生大量含CaCl2的废液。