(本题共12分)海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料。
(1).实验室里常用NaCl制取HCl。请在下图中选择合适的仪器用于发生HCl气体:
(填写仪器编号)。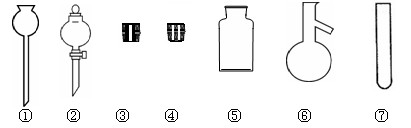
(2).在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是 。
(3).产生上述现象的原因是 。
(4).收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是: 。
(5).除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要 (填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性。
(6).工业上可用食盐作为一种主要原料,经不同的方法生产纯碱。联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是: 、 和避免产生大量含CaCl2的废液。
关于电解池应用的规律提炼题组
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
(1)通O2的Pt电极为电池 极(填电极名称),其电极反应式为 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为 ,电解质溶液为 。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在 电极(填“X”或“Y”)周围有固体沉积,该电极的电极反应式为 。
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变)。恢复到常温下,B电池溶液的pH= ,要使该溶液恢复到原来的状态,需加入 (填物质并注明物质的量)。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为 。
(6)若X、Y均是Pt,电解质溶液为Na2SO4溶液,通电一段时间后,在阴极上逸出c mol气体,同时有N g Na2SO4•10H2O 晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为 。
(学法题)通过以上题目,请总结书写电极反应式的关键 。
3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点 181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯 相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】
【实验装置】
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是 。
(2)反应装置中加干燥管是为了 。两个装置中冷凝管的作用 (填“相同”或“不相同”),冷却水进水口分别为 和 (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是 ,稀醋酸不能加多了,原因是 。用分液漏斗分离出酯层的操作叫 。碳酸钠溶液洗涤的目的是 。加碳酸钾的目的是 。
(4)采用减压蒸馏的原因是 。
(5)本实验所得到的3-丁酮酸乙酯产率是 (填正确答案标号)。
| A.10% | B.22% | C.19% | D.40% |
某化学兴趣小组设计如下流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42−)中提取铬.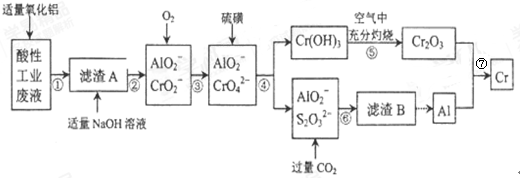
有关数据如表:
| 化合物 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| 完全沉淀的PH |
10.5 |
4.3 |
5.3 |
| 开始溶解的pH |
-- |
7.8 |
9.2 |
| Ksp近似值 |
10-12 |
10-14 |
10-31 |
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是____。
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在_______范围(保留小数点后l位)。
(3)步骤②中生成NaCrO2 的离子方程式为_____________。
(4)步骤④中反应的离子方程式为________________。
(5)步骤⑤在空气中充分灼烧的目的是__________________,可选用的装置是________。(填序号)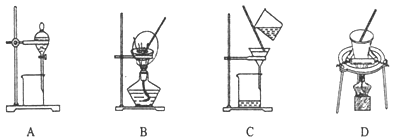
(6)步骤⑦中发生的化学反应方程式为____________________________。
氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。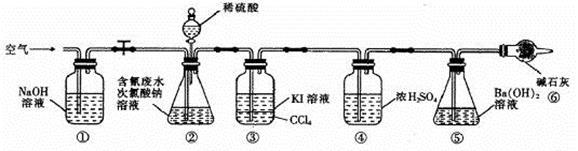
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(1)①和⑥的作用是 ;
(2)反应结束后,缓缓通入空气的目的是 ;
(3)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
探究二:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(4)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(5)下列选项错误的是__________
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等浓度的NaOH消耗等pH的HCOOH和HCN溶液的体积前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
(6)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为 。
(7)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
现有以下实验装置供实验时挑选使用。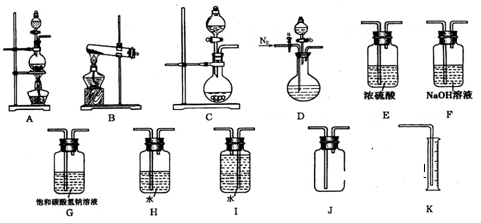
(1)利用Cu和浓硝酸反应制备NO2,用过氧化氢溶液和MnO2制取O2,根据反应原理应选用_______装置(填序号,从A、B、C中选取)。
(2)欲用石灰石和浓盐酸反应制取纯净干燥的CO2气体,将你所选的仪器按气体由左向右方向连接,连接顺序为: → G → → 。用饱和碳酸氢钠溶液除去挥发出的HCl优于用水除HCl的原因是_____________________。
(3)某小组为了探究Ag与浓硝酸反应过程中可能产生NO,设计了一连接顺序为D→H→I→K的实验装置。
①反应开始前通入N2的目的是______________________,
②反应结束,若H瓶中溶液体积为100mL,从中取出25.00mL溶液以酚酞作指示剂,用0.1000mol·L—1NaOH溶液进行滴定,两次滴定用去NaOH溶液的体积分别为16.98mL和17.02mL,则该瓶中硝酸的物质的量浓度为_______________。若实验测得NO的体积为95.2mL(已折算成标准状况),请你通过数据说明Ag与浓硝酸反应过程中________(填“是”或“否”)有NO产生。
(4)某同学设计下列四种制备NH3的方法,不合理的是_________(填序号)