(共10分) 某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)、按照甲同学的观点,发生反应的离子方程式为 。
两同学利用下图所示装置进行测定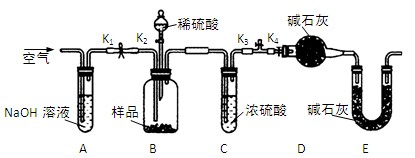
(2)、在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
(3)、装置E中碱石灰的作用是 。
(4)、实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同) ;
若未进行步骤 ,将使测量结果偏低。
(5)、若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuCO3的质量分数为 。
(6)、丙同学认为还可以通过测量 来测定沉淀中CuCO3的质量分数。
二氧化氯(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌、消毒剂。制备ClO2的方法有多种。
(1)纤维素还原法制ClO2。其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2。完成反应的化学方程式:其流程如下:□(A)+□NaClO3+□H2SO4=□ClO2↑+□CO2↑+□H2O+□______
(2)电解食盐水制取ClO2 ,其流程如下:
①粗盐中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中加入试剂的顺序依次为__________(填化学式),充分反应后将沉淀一并滤去,再加入盐酸。
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2 ,写出发生器中生成ClO2的化学方程式____________________。
③上述流程中,可循环利用的物质有__________;按照绿色化学原则,电解槽阴极产生的气体与方框中物质的物质的量之比为________时,原子的利用率为100%。
(3)实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
已知:(I)A气体在标准状况下的密度为0.089g/L;
(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝。
①电解时,发生反应的化学方程式为。
②NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为。
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2S2O3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4。
实验室可用如下装置(略去部分夹持仪器)模仿生成过程。
实验步骤:
(1)仪器组装完成后,,则整个装置气密性良好。装置D的作用是,装置E中溶液的作用是。
(2)先向C中烧瓶加入Na2S2O3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)等Na2S2O3和Na2S完全消耗后,结束反应。过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品。
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整。
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 |
|
| 步骤3:静置后取上清液,加入BaCl2溶液 |
(5)利用KMnO4标准溶液可以定量测定硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL0.01mol·L-1 KMnO4标准溶液,加硫酸酸化,再加过量KI溶液。写出该反应的离子反应:
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2 S4O62- +2I-),记录Na2S2O3溶液用量,滴定3次。指示剂最好选用,本次滴定时所用的玻璃仪器除锥形瓶外,还有。
S4O62- +2I-),记录Na2S2O3溶液用量,滴定3次。指示剂最好选用,本次滴定时所用的玻璃仪器除锥形瓶外,还有。
④若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为。
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
试回答:
(1)A中发生的化学反应方程式为。
(2)C、D、G中各装的药品:C__________;D__________;G__________。
(3)E中的现象为;反应方程式为。
(4)写出G中反应的离子方程式。
(5)若将Cl2和SO2等物质的量混合漂白作用减弱,用化学方程式解释原因。
海波(Na2S2O3·5H2O)常用手纺织和造纸工业,海波是无色透明的晶体,易溶于水,遇酸立即分解:S2O32— + 2H+ ="==" S↓+ SO2↑+ H2O。
硫化碱法是工业上制备海波的方法之一,反应原理为:2Na2S+Na2CO3+4SO2 ="==" 3Na2S2O3+CO2
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O,实验装置如下图所示: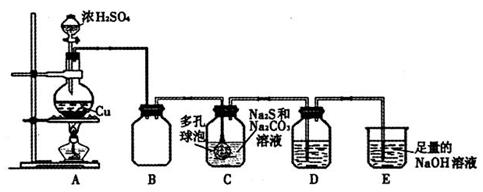
(1)装置A中滴加浓硫酸的仪器名称是,发生反应的化学方程式是,实验室还可以用A装置制取的气体单质有(填化学式)。
(2)装置C中连接多孔球泡可以提高S O2的吸收效率,其依据的原理是。
(3)装置D的作用是检验装置C中SO2的吸收效率,D中的试剂可以是。
a.品红溶液b.氢氧化钠溶液
c.酚酞溶液d.酸性高锰酸钾溶液
(4)装置E的作用是。
(5)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论:。
(6)Na2S2O3溶液是定量实验中的常用试剂,为了测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,滴加指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7) =mol·L-1。(已知:Cr2O72— +6I— +14H+="==" 2Cr3+ +3I2 +7H2O,2S2O32— + I2===S4O62—+2 I—)
某待测液中可能含有Ba2+、Fe3+、K+、Fe2+、CO32-、Cl-等离子,进行如下实验:
①取适量待测液于试管中,加入稀H2SO4,有白色沉淀生成;
②过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现;
③在步骤②中的溶液中,继续滴加氯水,溶液立即变红。
根据实验现象回答:
(1)待测液中一定含有的离子是,一定不含有的离子是;
(2)还有一种离子不能确定是否存在,要确认这种离子的实验方法和现象是。