PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。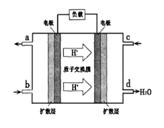
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。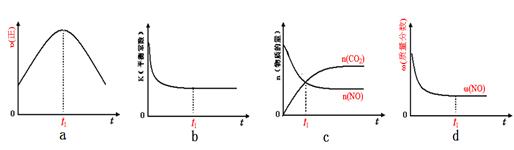
(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
2.16g某有机物在纯氧中完全燃烧,依次通入装有无水氯化钙干燥管和澄清石灰水,无水氯化钙干燥管增重1.44g,通过澄清石灰水得到沉淀14g。又知此有机物蒸气0.224L(已折算成标准状况下)的质量为1.08g。
⑴求此有机物的分子式。
⑵若此有机物跟FeCl3溶液作用显紫色,写出此有机物可能的结构简式。
21.(9分) )等物质的量混合的NaH CO3和KHCO3的混合物4.60 g,与1.00 mol/L的盐酸反应.
CO3和KHCO3的混合物4.60 g,与1.00 mol/L的盐酸反应.
(1)试分析,欲求标准状况下生成的CO2气体的体积,还需要什么数据________(用a表示,并注明单位).
( 2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
| 所需数据取值范围 |
生成CO2气体的体积 |
| 盐酸不足量时 |
|
| 盐酸足量时 |
(3)若NaHCO3和KHCO3的物质的量不相等,则4.60 g的混合物与足量盐酸完全反应时,标准状况下生成的CO2 气体的体积大于________L,小于________L.
气体的体积大于________L,小于________L.
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2K NO3 = 6K2O+N2↑),39.0g钾与10.1g硝酸钾充分反应生成K
NO3 = 6K2O+N2↑),39.0g钾与10.1g硝酸钾充分反应生成K 2O的物质的量为__________mol。
2O的物质的量为__________mol。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为_____________。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO2+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L(标准状况),列式计算反应消耗的KO2的物质的量。
一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol·L-1的NaOH溶液(密度为1.12 g·mL-1)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。 (1)原NaOH溶液的质量分数为__________。
(1)原NaOH溶液的质量分数为__________。
(2)所得溶液中Cl-的物质的量为__________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)︰n(H2)__________。
(8分)为了将10.0ml同时含H2SO4和HNO3的溶液完全中和,共消耗16.8ml物质的量浓度为2.38mol/L的Ba(OH)2溶液,这时生成6.99g沉淀。
(1)计算原溶液中每种酸的物质的量浓度。
(2)若将上述混合酸加水稀释到800.0ml,求稀释后溶液的PH.