合成氨工业对国防具有重要意义,如制硝酸、合成纤维以及染料等
(1)已知某些化学键的键能数据如下表:
| 化学键 |
N≡N |
H—H |
N—H |
| 键能kJ·mol-1 |
946 |
436 |
390 |
合成氨的热化学反应方程式为 。
(2)常温下,向饱和NaCl与饱和氨水的混合溶液中通入过量CO2,有NaHCO3固体析出,该反应的化学方程式为 ;所得溶液中离子的电荷守恒式是 ;若向饱和NaCl与饱和CO2的混合溶液中通入氨气,则没有NaHCO3固体析出,原因是 。
(3)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化。右图通过直接电化学氧化法有效除去某工厂氨气。其中阴离子的流动方向为 (填“向a极”或“向b极”),电解过程中,b极区的pH (填“增大”或“减小”或“不变”),阳极反应方程式为 。
(6分)现有下列物质, 用编号填空回答下列各问:
| A.干冰 |
| B.金刚石 |
| C.氩 |
| D.晶体硅 |
E.过氧化钠
F.二氧化硅
G.溴化铵
(1)通过非极性键形成的晶体是___________。
(2)固态时属于不含化学键的分子晶体是________。
(3)含有极性键的分子晶体是 。
(4)由极性共价键形成的晶体是_______ 。
(5)含有非极性键的离子化合物是 。
(6)含有离子键、共价键、配位键的化合物是 。
(1)研究硫及其化合物性质有重要意义。
硫酸工业生产中涉及如下反应:
2SO2(g)+O2(g)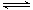 2SO3(g)。
2SO3(g)。
向2L的容器中充入2molSO2、1molO2,SO2的平衡转化率与温度的关系
如图所示。T1温度时反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”)。
温度为T1时,反应的平衡常数K= 。(单位必须写)若在T3温度时,达平衡时测得反应放出的热量为Q1。此时再向容器中加入2molSO2、1molO2并使之重新达到平衡,测得又放出热量Q2。则下列说法正确的是 。(填字母编号)
a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25°C时,Ksp[Mg(OH)2]=5.6×10-12 Ksp(MgF2)=7.4×10-11 。 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变);
25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+) (填增大、减小或不变); 在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是 (写化学式)。
(3)Al2(SO4)3溶液显示酸性,其原因是 (写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因: 。
(4)加热蒸发下列溶液,能析出得到原溶质的是
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液 d.盐酸
(5)25°C时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为 。
“嫦娥一号”的登月成功,实现了中国人“奔月”的梦想。
(1)2H2(g)+O2(g)=2H2O(l); H=-571.6kJ·mol-1
H=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ·mol-1
C8H18(l)+12.5O2(g)=8CO2(g)+9H2O(l); H="-5518" kJ·mol-1
H="-5518" kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) H =-890kJ·mol-1
H =-890kJ·mol-1
相同质量的H2、C、 C8H18、CH4完全燃烧时,放出热量最多的是 。
(2) 氢气、氧气不仅燃烧能放出热量,二者形成的原电池还能提供电能。“嫦娥一号”绕月飞行部分使用的是氢氧燃料电池,电解质溶液为KOH溶液,其电极反应式为:
负极 ;正极 ;
(3)若用氢氧燃料电池电解100mL由NaCl 和CuSO4组成的混合溶液,其中[Na+]=3[Cu2+]=0.3mol·L-1,用石墨作电极,通电一段时间后,在阴极收集到0.112L H2(标况).
试计算:
①阴极析出Cu mol。阳极析出气体为 (填化学式)。
②若所得溶液仍然为100mL,则此时溶液的pH值为 。
有下列各组物质,请按要求填入序号:
| A.O2和O3 |
B.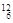 C和 C和 C C |
C.CH2=CH-CH2-CH3和 |
D.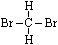 和 和 |
E. 和
和
①_________组两物质互为同位素。②_________组两物质互为同素异形体。③_________组两物质属于同系物。④_________组两物质互为同分异构体。⑤_________组中的物质是同一物质
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是 。
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3OCH3 |
(2)化合物A的分子式是C3H6O,A的核磁共振氢谱图如下图所示,则A的结构简式为: 。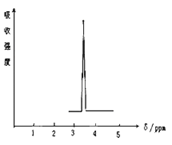
(3)用核磁共振氢谱的方法来研究C2H4Br2的结构,简要说明根据核磁共振氢谱的结果来确定C2H4Br2分子结构的方法是: 。