“禁止化学武器组织”获得2013年诺贝尔和平奖。Cl2是最早作为化学武器在战争中使用的有毒气体,但Cl2及其化合物在生活、生产中有广泛的用途,请回答下列与氯有关的问题:
(1)请画出氯离子结构示意图: 。
(2)漂白粉是灾后饮用水常用消毒剂,写出工业上制漂白粉的化学反应方程式: 。
(3)FeCl3可用作净水剂。室温时在FeCl3溶液中逐滴加入NaOH溶液,当pH=3时就开始产生沉淀,则原FeCl3溶液中c(Fe3+)大于 mol/L(已知:Ksp[Fe(OH)3=4.0×10-39])
(4)“84”消毒液的有效成分为NaClO,1mol Cl2 与含2mol NaOH溶液反应后,离子浓度由大到小的顺序为 。
(5)ClO2是高效水处理剂,用NaClO2与NCl3反应可以制得ClO2。已知在NCl3分子中成键原子共用电子对偏向于N原子,有关反应式为:
NaClO2 + NCl3 +H2O→ClO2↑+NH3↑+ NaCl + (未配平)。
①该反应中未知的生成物是 (填化学式)。
②该反应中被氧化的原子与被还原的原子的物质的量之比为 。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: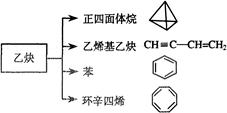
(1)正四面体烷的分子式为,其二氯取代产物有种
(2)关于乙烯基乙炔分子的说法错误的是:
| A.能使酸性KMnO4溶液褪色 |
| B.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应 |
| C.乙烯基乙炔分子内含有两种官能团 |
| D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同 |
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
、
(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g) CH3OH(g)ΔH2
CH3OH(g)ΔH2
①上述反应符合“原子经济”原则的是(填“Ⅰ”或“Ⅱ”),
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)的变化
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
I.由表中数据判断ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是,
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为,此时的温度为(从上表中选择);
(2)某实验小组依据甲醇燃烧的反应原理,设计如上图所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池负极的电极反应为。
已知 ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
试写出:
(1) A、E的结构简式分别为:、。
⑵写出下列转化的化学方程式:
C→D;
G+F→H。
(8分) 根据下面的反应路线及所给信息填空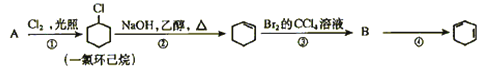
(1)A的结构简式是
(2)①的反应类型是。③的反应类型是。
(3)反应④的化学方程式是。
具有水果香味的中性物质A可以发生下列变化: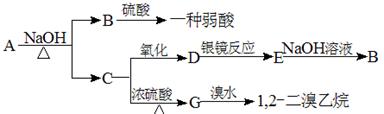
(1) 推断下述物质的结构简式:
A:________________ B:________________
C:________________ D:________________
(2) 写出下列变化的化学方程式:
A+NaOH→B+C:_____________________________________________
C→G:_________________________________________________
D→E:_________________________________________________