某有机物A(C8H13O2Br)在一定条件下可分别生成B1+C1和B2+C2。各物质之间的转化关系如图所示: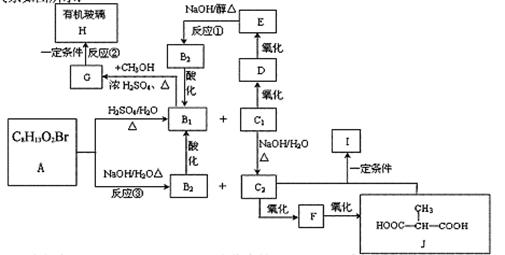
(1)C2的名称为 ,B1属于下列化合物中的 (填序号)。
①一元醇 ②二元醇 ③卤代烃 ④醛 ⑤饱和羧酸 ⑥不饱和羧酸
(2)写出下列化学反应类型:反应① ;反应② 。
(3)在不同的条件下,C2和J发生化学反应可以生成多种有机物I,请写出满足下列条件的两种I的结构简式:
①C2和J按物质的量之比为1:1反应生成的最小环状化合物 。
②C2和J按物质的量之比为1:1反应生成的链状高分子 。
(4)写出③的化学反应方程式 。
(5)满足如下条件的有机物有 种(不考虑手性异构)。
①与C2相对分子质量相同;
③该物质分子中含两种不同的官能团,且Imol该物质能与金属钠反应生成1mol氢气。
(6)有机物M(C3H6O)的核磁共振氢谱显示只有一种氢,由M为有机原料也可制得有机玻璃H。请参考以下信息,写出用M和甲醇为原料(其它无机试剂任选)制备有机玻璃H的合理流程图。
酯类是工业上重要的有机原料,具有广泛用途。
下图是乙酸乙酯的合成路线图,已知A能与银氨溶液反应析出银镜,B的水溶液可以溶解CaCO3,E可作果实催熟剂。
请完成下列问题:
(1)A的名称是;B中所含的官能团是;反应③的反应类型是;反应④的反应类型是。
(2)A的结构简式为;E的结构简式为。
(3)请写出反应①、④的化学方程式:
①;
④。
已知一个碳原子上连有两个羟基时,易发生下列转化:
请根据下图回答问题:
(1)E中含有官能团的名称是;③的反应类型是,C跟新制的氢氧化铜反应的化学方程化为。
(2)已知B的相对分子质量为162,其燃烧产物中 则B的分子式为,F的分子式为。
则B的分子式为,F的分子式为。
(3)在电脑芯片生产领域,高分子光阻剂是光刻蚀 线宽芯片的关键技术.F是这种高分子光阻剂生产中的主要原料.F具有如下特点:①能跟
线宽芯片的关键技术.F是这种高分子光阻剂生产中的主要原料.F具有如下特点:①能跟 溶液发生显色反应:②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为。
溶液发生显色反应:②能发生加聚反应;③芳环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应.G可能有种结构,写出它们的结构简式。
A是乙烯与水加成后的产物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
(1)写出A的化学式。
(2)下列反应的化学方程式及反应类型
反应①反应类型:;
反应②反应类型:;
反应③反应类型:;
反应④反应类型:;
(3)比较反应①与钠和水反应的现象有什么相同和不同
相同点:。
不同点:。
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。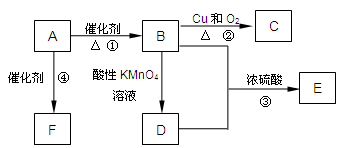
(1)A的结构式为__________,C的名称为__________。
(2)B分子中的官能团名称是_______,请设计一种验证B物质存在该官能团的方法__________。
(3)写出下列反应的化学方程式并指出反应类型:
①__________________________________________;反应类型是_____________;
④__________________________________________;反应类型是_____________。
(10分)惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
试回答下列问题:
(1)F的结构简式为。
(2)反应②中另加的试剂是;反应⑤的一般条件是。
(3)反应③的化学方程式为。
(4)上述合成路线中属于取代反应的是(填编号)。