a mo1 FeS与b mol FeO投入到稀硝酸溶液中充分反应后无固体剩余,得到Fe(NO3)3相H2SO4的混合溶液,并产生NO气体。则反应中氧化产物与还原产物的物质的量之比为
A. |
B. |
C.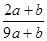 |
D.不能确定 |
下列离子方程式中,正确的是
| A.氧化铜与稀盐酸反应:Cu2++2Cl-==CuCl2 |
| B.在澄清石灰水中通入过量的二氧化碳气体:OH-+CO2==HCO3- |
| C.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-==BaSO4↓ |
| D.石灰石和盐酸反应:CO32-+2H+==CO2↑+H2O |
下列说法正确的是
| A.将AgCl放入水中不能导电,故AgCl不是电解质 |
| B.CO2溶于水得到的溶液能导电,所以CO2是电解质 |
| C.金属能导电,所以金属是电解质 |
| D.固态的NaCl不导电,熔融态的NaCl能导电,NaCl是电解质 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.2.3g金属钠变为钠离子时失电子数为0.1NA |
| B.1molOH- 中含有的电子数为10NA |
| C.在常温下22.4L氢气所含有的原子数目为NA |
| D.100mL0.1mol/L稀硫酸中含有硫酸根的个数为0.1NA |
在强碱性溶液中能大量共存且溶液为无色透明的离子组是
| A.K+、Na+、CO32-、NO3- | B. Na+、NH4+、NO3-、Cl- |
| C.K+、Ba2+、HCO3-、Cl- | D. Na+、K+、SO42-、MnO4- |
要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是
| A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |