多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为_______________________________________
(2)用H2还原SiCl4蒸汽可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反 应的热化学方程式为_____________________________________________
(3)加钡矿粉并调节pH=7的目的是① ,②
(4)过滤②后的滤液中Fe3+浓度为 (滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)
(5)生成滤渣A的离子方程式__________________________________________
(6)列式计算出10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量为多少吨?
经分析,某芳香族化合物A含有C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物相对分子质量为108。
(1)通过计算,写出该有机物的分子式。
(2)如果该有机物遇FeCl3溶液显紫色,写出满足要求的所有有机化合物分子的结构简式。
在一定条件下,有aLO2和O3的混合气体,当其中的O3完全转化为O2时,体积变成1.2aL,求原混合气体中O2和O3的质量分数?
常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
在标准状况下,CO和CO2的混合气体共67.2L,质量为116g.求:
(1)两种气体的物质的量之和为多少mol?
(2)其中CO2为多少 mol?
(3)CO的体积分数为多少?
(11分)恒温、恒压的条件下,将N2和H2按体积比1:3混合充入一密闭容器中,发生下列反应 N2 + 3 H2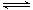 2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
2NH3,达平衡时,测得气体体积为起始气体体积的0.75倍,求:(1)平衡时N2的转化率;
(2)平衡时混合气体中NH3的体积分数;
(3)平衡时混合气体的相对分子质量与起始气体的相对分子质量之比.
(请写出计算过程)