美国科学家理查德·海克和日本科学家根岸英一、伶木彰因在研发“有机合成中的钯催化的交叉偶联”而获得诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收,一种由废催化剂制取氯化钯的工艺流程如下:
(1)甲酸还原氧化钯的化学方程式为 。
(2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdC14,硝酸被还原为NO,该反应的化学方程式为: 。
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1—图3所示,则王水溶液钯精渣的适宜条件(温度、时间和王水用量)为 、 、 。
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2—。此时铁的存在形式是 (写化学式)
(5)700℃焙烧1的目的是: ;550℃焙烧2的目的是: 。
(1) 的名称是__________________________________
的名称是__________________________________
(2)2,4,6三甲基5乙基辛烷的分子中共有________个甲基原子团。
(3)分子中有6个甲基而一溴代物只有1种的烷烃的分子式是_________,其结构简式是__________,名称是____________________。
(16分,每空2分)现有如下两个反应:
(A)KOH + HNO3 = KNO3 + H2O(B)H2SO4+ Zn= ZnSO4+H2↑
(1)根据两反应本质判断能否设计成原电池:(A)(B)。
(2)如果不能,说明其原因。
(3)如果可以,则写出作原电池的正极材料名称:,电极反应式:负极;正极。
(4)在铜锌原电池中,以稀硫酸为电解质溶液,若工作一段时间后,锌片的质量减少了32.5克,则铜片表面析出了氢气L,(标准状况下),导线中通过mol电子。
(16分,每空2分)下表列出了①--⑨九种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④在周期表中所处位置,从元素原子得失电子的角度看,元素④具有_____(填“氧化性”或“还原性”);
(2)写出④⑥⑦三种元素的气态氢化物稳定性由弱到强的顺序排列:____(写氢化物的化学式);
(3)写出元素⑤形成的单质在氧气中燃烧的化学反应方程式,这一反应是(填“吸热”或“放热”)反应;
(4)用电子式表示①与⑨反应得到的化合物的形成过程。
(5)在①--⑨九种元素中最高价氧化物对应的水化物中,酸性最强的是(填对应化合物的化学式,下同)___________,碱性最强的是________________ 。
(本题有2小题,共16分,每空2分)
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________。
②工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。
③工作时,电解质溶液中阴离子移向________极。
④电流方向从________极流向________极。
(2)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题: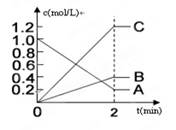
①该反应的反应物是。
②该反应的化学方程式为。
③在0-2min,该反应用A表示的平均反应速率为。
(16分,每空2分)用A+、B-、C2-、D、E、F分别表示含有10个电子的微粒,其中A、B、C是含单核的微粒,D、E、F 是分子。请回答:
(1)A是、B是、C是(用微粒符号表示) 。
(2)D是由两种元素组成的双原子分子,其化学式是。
(3)E是由两种元素组成的三原子分子,其化学式是,电子式是。
(4)F分子中含有5个原子,其化学式电子式表示它的形成过程。