氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:
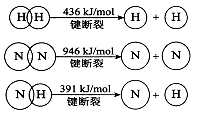
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K (填“增大”、“减小’’或“不变”)。
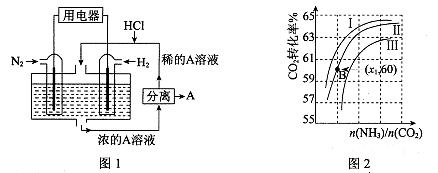
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。
(4)用氨合成尿素的反应为2NH3(g)+CO2(g)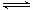 CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比 、水碳比
、水碳比 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
已知:①一个碳原子上连有两个羟基时,易发生下列转化:(R、R'代表烃基或氢原子)。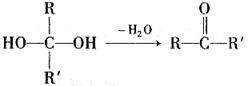
②同一个碳原子上连有两个双键的结构不稳定。根据下图回答有关问题: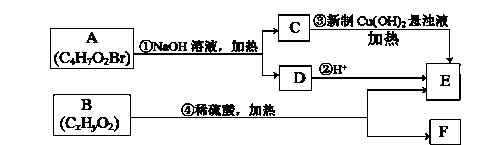
(1)E中含有的官能团的名称是;C与新制氢氧化铜反应的化学方程式为。
(2)A的结构简式为。A不能发生的反应有(填字母)。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(3)已知B的相对分子质量为188,其充分燃烧的产物中n(CO2):n(H2O)=2:1。则B的分子式为。
(4)F具有如下特点:①能与FeCl3溶液发生显色反应;②核磁共振氢谱中显示有五种吸收峰;③苯环上的一氯代物只有两种;④除苯环外,不含有其他环状结构。写出两种符合上述条件,具有稳定结构的F可能的结构简式:。
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 |
元素性质或原子结构 |
| X |
原子的最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T |
与Z同周期,元素最高价是+7价 |
| W |
原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______;W元素基态原子电子排布式
为______________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________________。
A.常温下Z的单质和T的单质状态不同
B. T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D. T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为______,它所形成的晶体类型为______; Y的常见氢化物易液化的主要原因是________________________。
(4)元素X与钙元素可以形成一种离子化合物,该化合物的阴离子和CO互为等电子体,该化合物的电子式为;其中元素X的杂化类型是。
(14分)2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应的平衡常数表达式。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
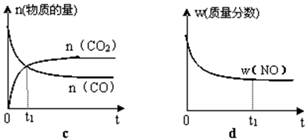
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol
2NO2(g)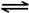 N2O4(g)△H=-56.9 kJ/mol
N2O4(g)△H=-56.9 kJ/mol
H2O(g) = H2O(l)ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:。
(3)在一定条件下,也可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。则2 molCH4与足量H2O(g)反应最多可生成_______mol H2,写出该反应的化学方程式_________________________________________________。
(5)上述方法制得的H2可以和CO在一定条件下合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油 b.甲醇c.甲醛 d.乙酸
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、A13+和五种阴离子Cl-、OH-、NO3-、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断五种物质中肯定有的两种物质是_____________和__________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为__________(填字母)。
A.Br- B.SO42-C.CH3COO- D.HCO3-
(3)将19.2g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式__________,若要将Cu完全溶解,至少应加入H2SO4的物质的量是_______。
(4)若用惰性电极电解C和D的混合溶液,若溶质的物质的量均为0.1 mol,通电后,当在阴极产生气体1.12L时,阳极产生的气体体积为___________L。(气体体积均为标准状况,且不考虑气体在水中的溶解)
(5)将E溶液蒸干后并将所得固体灼烧,最终得到的固体成分是(填化学式)__________。
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l)+3 O2 (g)=2CO2(g)+3H2O(l)△H="-1366.8" kJ/mol
②2H2 (g)+O2 (g)=2H2O(l)△H="-571.6" kJ/mol
(1)写出由CO2和H2 反应合成CH3CH2OH (l)和H2O(l)的热化学方程式。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。通入乙醇燃气的一极为极,该极上的电极反应式为。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图:
该装置中发生电解反应的方程式为;在铁棒附近观察到的现象是;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为。(不考虑气体的溶解及溶液体积的变化)