锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: 。
(2)PO43—的空间构型是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是 。
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
a.离子键 b.极性键 c.金属键
d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为 。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。 
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式:。
(2)此反应的还原剂是___________,它的氧化产物是。
(3)此反应的离子反应方程式可表示为:________________________________________。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有___________。
(1)某反应池中,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示: ①
①
配平上面化学方程式,将系数填入方框中。
②将铵态氮中的1 mg氮转化成硝酸根中的氮,需氧气多少毫克?
③为什么在反应中需要不断添加碱?
(2)3级反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示: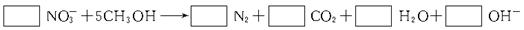
配平上面化学方程式,将系数填入方框中。
(1)在澄清石灰水中通入CO2,直至过量。
(2)在硫酸和盐酸混合溶液中滴加氢氧化钡溶液,直至过量。
(3)在碳酸钡的悬浊液中加盐酸,直至过量。
回答:(1)_______(2)________(3)________。
(1)写出上述两个反应的化学方程式:①_____________;②_________________。
(2)试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由:________。
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面二氧化硫的浓度。在二十世纪六七十年代的10年间,由发电厂排放出的二氧化硫增加了35%,但由于建造高烟囱的结果使地面二氧化硫的浓度降低了30%之多。请从全球环境保护的角度,分析这种方法是否可取?答____________________。
(1)分析判断A和B 各是什么物质,写出各自的化学式。
(2)写出①~⑦各步反应的化学方程式。
