下列根据实验操作及现象所得出的结论中,正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向两份蛋白质溶液中分别滴加NaCl溶液和 CuSO4溶液。均有固体析出 |
蛋白质均发生了变性 |
| B |
取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化, 滴‘加KSCN溶液,溶液变为红色 |
该Fe(NO3)2试样已经 变质 |
| C |
将少量某物质的溶液滴加到新制的银氨溶液中, 水浴加热后有银镜生成 |
该物质一定属于醛类 |
| D |
同条件下,分别将0.1mol·L-1的盐酸和醋酸进 行导电性实验,与醋酸串联的灯泡较暗 |
醋酸是弱酸 |
下列离子方程式的书写与所给的前提条件不相吻合的是()
| A.将4 molCl2通入到含有4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-= 4Cl-+Br2+2Fe3+ |
| B.已知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大。则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2— + SO2+ 3 H2O = 2 Al(OH)3↓+SO32— |
| C.稀的氨水溶液吸收了少量的二氧化碳气体:2NH3 ·H2O + CO2 = 2NH4+ + H2O + CO32- |
| D.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是: |
2Al3+ +3SO42-+3Ba2+ +6OH—= 3BaSO4↓+2Al(OH)3↓
25℃时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L HA酸溶液,溶液pH变化曲线如下图所示,仔细观察下图,判断有关说法中不正确的是( )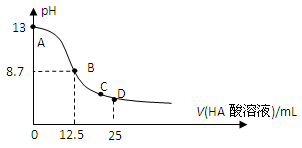
A.HA酸是弱酸
B.当滴定过程中溶液pH=7时,c(Na+)=c(A-)>c(OH-)=c(H+)
C.在C点:c(Na+)>c(A-)>c(H+)>c(OH-)
D.在D点:c(A-)+c(HA)=2c(Na+)
室温下,某未知溶液中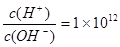 ,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6 种离子;①SiO32-②NH4+③Fe2+ ④Na+ ⑤HCO3-⑥Cl-,其中不必检验就能加以否定的离子是()
,且含有大量Al3+和NO3-,检验此溶液中是否大量存在以下6 种离子;①SiO32-②NH4+③Fe2+ ④Na+ ⑤HCO3-⑥Cl-,其中不必检验就能加以否定的离子是()
| A.①③⑤ | B.②③④ | C.①②⑥ | D.④⑤⑥ |
室温下浓度为0.01 mol / L的三种一元酸溶液:HA、HB、HC,其中HA的c(H+)=0.001 mol / L,HB的电离度为0.1%,HC的c(OH-)=1×10-12mol / L,则室温下三种酸所形成的钠盐:NaA、NaB、NaC的溶液在物质的量浓度相同的情况下,其pH值由大到小的顺序是()
A.NaA>NaB>NaC B.NaB>NaA>NaC
C.NaB>NaC>NaA D.NaC>NaA>NaB
在固定容积的密闭容器中,可逆反应2X(?)+Y(g) Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是()
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是()
| A.正反应为放热反应,X可能是气态、液态或固态 | B.正反应为放热反应,X一定为气态 |
| C.若X为非气态,则正反应为吸热反应 | D.若加入少量的Z,该平衡向左移动 |