工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)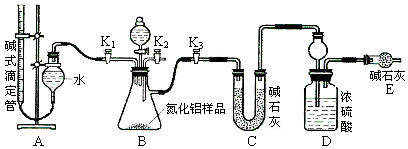
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞 ,打开活塞 ,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞 ,打开活塞 ,通过分液漏斗加入过量 (填化学式),与烧瓶内物质充分反应。
④ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积 (填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 。(该实验条件下的气体摩尔体积为Vm)。
(15分)S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2 CCl4+S2Cl2;② 2S+Cl2
CCl4+S2Cl2;② 2S+Cl2 S2Cl2。
S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2 2SCl2。
2SCl2。
下列是几种物质的熔沸点和反应装置图:
| 物质 |
沸点/℃ |
熔点/℃ |
| S |
445 |
113 |
| CS2 |
47 |
-109 |
| CCl4 |
77 |
-23 |
| S2Cl2 |
137 |
-77 |
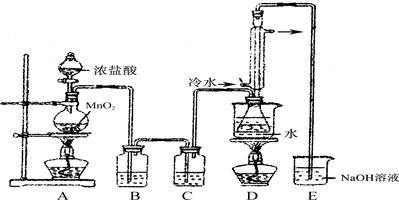
(1) 利用上图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是________(填写以上两种反应原理的数字序号)。
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是________。
(3)D装置中冷凝管的作用是________________;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是________。
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为____________________。
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和________。
(6)上图尾部装置不够完善,存在的问题是____________。
(12分)NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收,得到NaNO2、NaNO3和Na2CO3的混合液及CO2气体。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0 t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1)第一步生产过程中发生反应的总化学方程式是____。
(2)检验NaNO3成品中是否含少量的Na2CO3杂质的方法是____。
(3)生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4)生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积至少为________m3(标准状况下)。
某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·nH2O)分解的实验探究。
经过小组讨论,他们设计了如下装置进行实验(夹持装置未画出):烧瓶A中盛有饱和NH4Cl和饱和NaNO2的混合液(常用于实验室制N2),干燥管B、G中装有碱石灰,试管D、F、I中盛有澄清石灰水。
(1)连接好装置后,加入药品前,应该进行的实验操作是____________________(填操作名称)。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________________;然后停止加热,关闭活塞a,实验结束前,还要打开活塞a,加热烧瓶A一段时间,其目的是_。
Ⅰ.定性研究:
(3)试管D中出现浑浊,证明产物中有____________存在,证明分解产物中存在CO的现象是________,要证明分解时产生的另一种气态产物的存在应该如何改进装置___________;将充分反应后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为。
Ⅱ.定量分析(假定每一步反应进行完全):
(4)取7.2 g样品进行实验,测得硬质玻璃管C中残余固体2.88 g,硬质玻璃管H中固体质量减轻0.64 g,则草酸亚铁晶体(FeC2O4·nH2O)分解的化学方程式为:。
明矾石的组成和明矾相似,此外还含有Al2O3和少量的Fe2O3等杂质,它是制取钾肥和冶炼铝的重要原料,其生产工艺流程如下: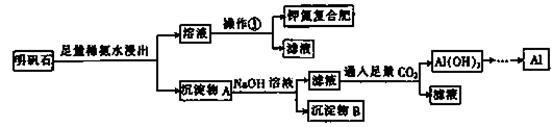
请回答下列问题:
(1)明矾石加入足量的稀氨水中浸出时发生反应的离子方程式为:。
(2)沉淀物A中除含有Fe2O3外,还含有________、________。
(3)操作①的步骤及名称为________、冷却结晶、过滤洗涤、室温干燥。
(4)用14 mol·L-1的浓氨水配制75 mL 2 mol·L-1稀氨水:
① 准确量取mL浓氨水,置于烧杯中,加适量蒸馏水稀释 ,放置到室温后再将溶液转入,洗涤,定容,摇匀。
②配制稀氨水时如何定容。
③下列操作会使所配制的稀氨水浓度偏小的是。
| A.用量筒量取浓氨水后,未用蒸馏水洗涤量筒并转移至容量瓶中 |
| B.洗涤后的容量瓶中有少量蒸馏水 |
| C.定容时观察液面俯视 |
| D.定容摇匀后,发现液面下降,继续加水至刻度线 |
(5)确定钾氮复合肥中含有钾元素的方法是。
实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:
装置Ⅰ,装置Ⅱ,装置Ⅲ。
(3)开始进行实验时,首先应进行的操作是。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会(填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是________________(用含字母的代数表示)。