某研究小组探究:
I .铜片和浓硫酸的反应(夹持装置和A中加热装置已略,气密性已检验)
II. SO2和 Fe( NO3)3溶液的反应[1.0 mol/L的 Fe(NO3)3溶液的 pH=1]请回答下列有关问题:
探究I
(l)某学进行了下列实验:取12.8g铜片和20 mL 18 mol•L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。
①装置A中反应的化学方程式是_______
②该同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
| A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴 |
| B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定其产生气体的体积(折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况) |
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______。
(3)裝置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1:SO2与Fe3+反应;猜想2 :在酸性条件下SO2与NO3-反应;猜想3:____________;
①按猜想1,装置B中反应的离子方程式是______,证明该猜想应进一步确认生成的新物质,其实验操作及现象是____________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
a.0.1 mol/L 稀硝酸 b. 1.5 mol/L Fe(NO3)2溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
某化学兴趣小组用下图所示装置进行探究实验,以验证烧瓶中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到溴水褪色,烧瓶中浓硫酸与乙醇的混合液变为棕黑色。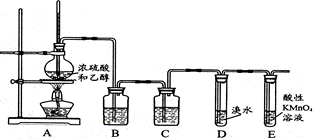
(1)烧瓶中除了浓硫酸和乙醇之外,还放入了___________,其作用是_______________
(2)写出该实验中生成乙烯的化学方程式:______________________________________
(3)B瓶中盛装的溶液是___________,其作用是________________________________
(4)C瓶中盛装的溶液是___________,其作用是_________________________________
(5)考虑到A中混合液反应的复杂性,如果没有B、C装置,D中溴水褪色的现象不能证明A的烧瓶中有乙烯生成且具有不饱和性,其理由是___________(填下列这项的序号)。
①乙烯与溴水易发生取代反应②使溴水褪色的反应未必是加成反应
③使溴水褪色的物质未必是乙烯④浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
 |
(5分)已知化学反应N2+3H2=2NH3的能量变化如图所示, 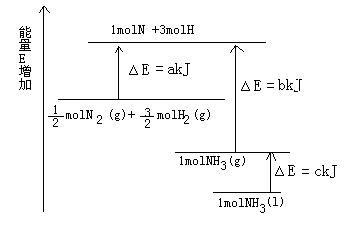
(1)1mol N 和3mol H 生成1mol NH3(g)是能量的过程(填“吸收”或“释放”)。
(2) N2(g)+
N2(g)+ H2(g)=NH3(g);
H2(g)=NH3(g);
△H=;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
(12分)依据事实,写出下列反应的热化学方程式。
⑴在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
⑵若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
⑶用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。___________________________________
⑷已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
已知乳酸的结构简式为 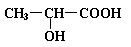 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称);
(2)乳酸与金属钠溶液反应的化学方程式为
___________________________________________________________________;
(3)乳酸与Na2CO3溶液反应的化学方程式为
___________________________________________________________________;
(4)当乳酸和浓硫酸共热时,能产生多种酯类化合物,任意写出一种该类产物的结构简式
古代的“药金”外观与金相似,常误以为是金子。冶炼方法如下:将碳酸锌、赤铜(Cu2O)、木炭混合加热至800℃得金光闪闪的“药金”。
(1)“药金”的主要成分是 。
(2)有关冶炼的化学方程式是 、
、
。