TiO2在工业生产和日常生活中有重要用途。
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得: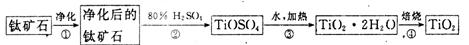
其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 ="=" TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字): 。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g)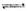 TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H=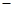 394 kJ/mol。
394 kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为: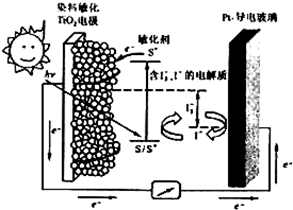
TiO2/S TiO2/S*(激发态)
TiO2/S*(激发态)
TiO2/S*  TiO2/S+ + e-
TiO2/S+ + e-
I3-+2e- 3I-
3I-
2TiO2/S*+I3-  2TiO2/S + I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是
| A.电池工作时,I-离子在镀铂导电玻璃电极上放电 |
| B.电池工作时,是将太阳能转化为电能 |
| C.电池的电解质溶液中I-和I3- 浓度不会减少 |
| D.电池中镀铂导电玻璃为正极 |
分类是学习和研究化学的一种重要方法,下列分类合理的是
| A.K2CO3和K2O都属于盐 | B.H2SO4和HNO3都属于酸 |
| C.KOH和Na2CO3都属于碱 | D.Na2O和Na2SiO3都属于氧化物 |
下列离子方程式正确的是
| A.碳酸钡与足量盐酸反应:2H++BaCO3=Ba2++H2O+CO2↑ |
| B.氯气通入蒸馏水中:Cl2+H2O=Cl﹣+ClO﹣+2H+ |
| C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42﹣+H++OH﹣=BaSO4↓+H2O |
| D.过量CO2通入澄清石灰水中:CO2+Ca(OH)2 =CaCO3↓+H2O |
某课外实验小组设计的如图实验合理的是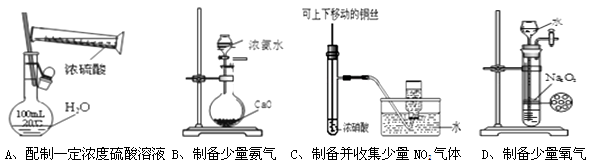
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
| A.使红色布条退色(HCl) |
| B.滴加AgNO3溶液生成白色沉淀(Cl-) |
| C.将NaHCO3固体加入新制氯水中,有无色气泡(H+) |
| D.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
对于反应①KHCO3溶液与石灰水反应;②Na2CO3溶液与稀盐酸反应;③Na与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量或浓度,不能用同一个离子方程式表示的是
| A.①②③ | B.①③④ | C.①②④ | D.②③④ |