硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。溶液由棕黄色变为浅绿色用离子方程式表示为_____,后又由浅绿色变为棕黄色的离子方程式为_____。
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: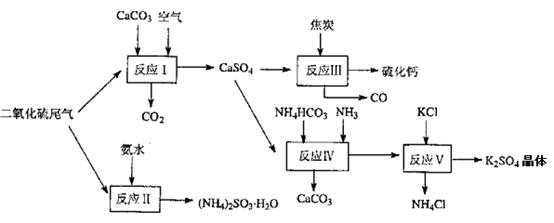
写出反应反应Ⅳ的化学方程式 ;
反应III中氧化剂与还原剂的物质的量之比为__ __;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是 。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如下图所示:
若2molZnFe2Ox与SO2反应可生成 0.75molS,x= ,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式 。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t。
(1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。分析有关数据,写出X、Y、Z反应的化学方程式。
(2)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中的化学方程式进行反应,当达到化学平衡时,测得Z的物质的量分数为25%,求平衡时X的转化率。
如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)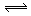 C(g)+2D(g) ΔH<0;达到平衡(Ⅰ)时,V(乙)="0.86V" L。请回答:
C(g)+2D(g) ΔH<0;达到平衡(Ⅰ)时,V(乙)="0.86V" L。请回答: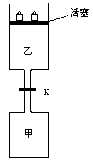
(1)乙中B的转化率为
(2)甲中D和乙中C的物质的量比较:(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为(用含V的代数式表示,连通管中气体体积忽略不计。)
将一定量的CO2气体通入500 mL某NaOH溶液中,充分反应后。将溶液在低温下蒸发。得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50 mL相同浓度的盐酸反应.得到气体的体积(标准状况)如下表所示。
| 组别 |
① |
② |
③ |
| 盐酸的体积mL |
50 |
50 |
50 |
| 固体A的质量g |
3.80 |
6.20 |
7.20 |
| 气体体积mL |
896 |
1344 |
1344 |
上表中第组数据表明加入的50mL盐酸有剩余,其理由是?
通过计算讨论判断固体A是什么物质?其成分的质量分数是多少?
元素R的气态氢化物化学式为HxR.在标准状况下,8.5gHxR气体的体积是5.6L。将5. 1gHxR气体通入200ml 0.75mol/L的CuCl2溶液中正好完全反应,并生成黑色沉淀
(1)求HxR的相对分子质量;
(2)推断x值,并确定R元素的名称.
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)△H=—97.3kJ/mol
SO2Cl2(l)△H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是(用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42-浓度之比为。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。