某研究性学习小组的同学用电解水的方法测定水的组成后,提出问题:"测定水的组成还有其他的方法吗?"经过讨论后,得到了肯定的答案,邀请你一起对此展开探究。
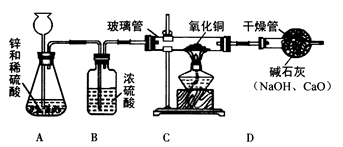
[设计方案]甲同学利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)。装置
中发生反应的化学方程式为 ,洗气瓶
中浓硫酸的作用为
[实验探究]当玻璃管中固体由黑色转变为红色时,实验测得:
①装置 的玻璃管和其中固体的总质量在反应后减少了 ;
②装置
的干燥管和其中物质的总质量在反应后增加了
,用此数据算得水中
、
元素的质量比为 ,而由水的化学式算得
、
元素的质量比为 。
[分析交流]针对上述结果与理论值有偏差,乙同学认为:该装置存在缺陷,此观点得到了大家的认同,你对此改进的方法是 (假设生成的水完全被D中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计)。小组同学用改进后的装置重新实验得到了正确结果。
[意外发现]丙同学不小心将反应后的少量红色固体
洒落到多量稀硫酸中了,发现除了有红色固体
以外,溶液的颜色由无色变为蓝色。
[提出问题]铜与稀硫酸是不反应的,这里溶液的颜色为什么会变蓝呢?
[查阅资料]①
被还原的过程中会有
生成,
也能被还原在
② 固体是红色的,它一稀硫酸的反应为: .
[得出结论]红色固体
中含有
。
[分析交流]红色固体
中含有
是否会影响水组成的测定结果 (填"影响"或"不影响")。
[提出猜想]针对红色固体
的成分,小组同学提出猜想①是:
和
;猜想②是: 。
[拓展探究]丁同学利用改进后的装置及药品重新实验,通过测量反应前后固体质量的方法去确定哪种猜想成立,他已称得:①玻璃管的质量;②反应前红色固体
和玻璃管的总质量,完全反应后,你认为他还需要称量 的质量。
[教师点拨]称取一定质量的红色固体
与足量的稀硫酸充分反应后,经过滤、洗涤、干燥后再称量红色固体b的质量,也可以确定哪种猜想成立。
[定量分析]小组同学再次实验,他们开始称取质量为
的红色固体a,与足量的稀硫酸完全反应后得到红色固体
为
。假如
红色固体
都是
,请你计算出生成铜的质量(利用
.进行计算,写出计算过程);然后,通过与实际得到的固体
进行比较,判断猜想 成立(填①或②)。
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应。这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入一块纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
无论是用5%H2SO4还是用10%H2SO4,均无明显现象。其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合。
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:Cl-能
假设二:SO42-能
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)_______________
(12分)下图是实验室中用于制取、干燥和收集气体的装置图。实验课上同学们用过氧化氢溶液与二氧化锰混合制取并收集氧气,试回答: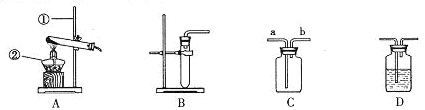
⑴写出A图中带标号仪器的名称:①_______________,②_______________。
⑵用该方法制取氧气的化学方程式是_____________________________________。
⑶该方法制取氧气的发生装置应选择___________,若有C装置采用排水法收集氧气,进气口为____________。(填a或b)
⑷若用D装置干燥氧气,D中应盛放的试剂是___________________。
⑸甲、乙、丙三名同学用所选装置合作实验过程中,胶塞突然弹飞,并有少量的液体溅到实验台和衣服上。就此异常现象三名同学探究如下:
【问题】为什么胶塞会突然弹飞呢?
【查阅资料】①容器内瞬间产生气体过多,压强过大,可能导致胶塞弹飞。
②化学反应速率与反应物的浓度、接触面积、温度、催化剂等因素有关。
【猜想】甲同学:导气管堵塞或弯折造成的。乙同学:过氧化氢溶液用量过多造成的。丙同学:过氧化氢溶液的溶质质量分数过大造成的。
【分析验证】通过检查实验装置发现导气管没有堵塞、弯折的情况;与实验成功的小组同学交流,得知各小组所用过氧化氢溶液溶质的质量分数均相同。于是他们否定了____________两名同学的猜想。请你设计实验,验证另一名同学的猜想是导致本次实验胶塞弹飞的主要原因。
【交流反思】⑴老师建议他们可以通过改进发生装置的方法,避免胶塞弹飞。你对所选的发生装置有何改进设想?(语言叙述或画图均可)
⑵实验结束后,有的同学发现衣服和手上出现有白色的斑点。由此推出过氧化氢溶液还具有的一条性质________________________。
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 X ”。这个化学方程式中最后一种物质X的化学式是:。
(2)“二氧化硫和二氧化碳一样,也能使澄清石 灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:______________________。
灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:______________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验: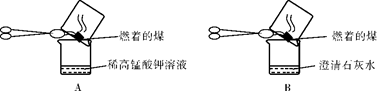
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:。
(5)丙同学:“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是。
(7)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中。
5月1号起"醉驾入刑"。醉酒的原因是酒中含有一种物质叫乙醇,对人的神经系统有刺激作用。醉酒后驾车会带来严重的社会危害。
(1)乙醇(
)易燃烧,燃烧的化学方程式为。
(2)交警进行呼气酒精检测的原理是:橙色的
酸性溶液遇乙醇迅速生成蓝绿色的硫酸铬,硫酸铬有
和
组成,则硫酸铬的化学式为。
(3)白酒是乙醇的水溶液,酒中乙醇在微生物的作用下能被氧化成乙酸,现有一瓶密封放置了十几年的某种白酒,想知道该白酒的组成情况,设计了如下探究实验:
【提出问题】白酒中溶质有哪些?
【查阅资料】
材料一:乙醇(
),俗称酒精,易溶于水,水溶液呈中性。
材料二:乙酸(
),又名醋酸,易溶于水,具有酸的通性。
【猜想】
猜想1:只有乙醇
猜想2:只有乙酸
猜想3:。
【实验探究】
已知某纯碱样品中含有NaCl杂质,为测定样品中纯碱的质量分数,可用下图中的装置进行实验(温馨提示:碱石灰的主要成分是NaOH和CaO)。主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag样品放入锥形瓶中,加适量蒸馏水溶解,得到样品溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入稀硫酸到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到盛有碱石灰的U型管的质量基本不变,为dg
请回答下列问题:
(1)在用托盘天平称量样品时,如果天平的指针向右偏转,说明;
(2)装置中
溶液的作用是;
(3)装置中浓硫酸的作用是:
(4)如果将分液漏斗中的稀硫酸换成浓度相同的盐酸,测定的结果会(填偏高、偏低或不变):
(5)步骤⑤的目的是;
(6)该样品中纯碱的质量分数的计算式为: