现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。 |
| B元素原子的核外p电子数比s电子数少1。 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满。 |
| E元素的主族序数与周期数的差为4。 |
| F是前四周期中电负性最小的元素。 |
| G在周期表的第七列。 |
(1)已知BA5为离子化合物,写出其电子式__________________________________。
(2)B的基态原子中能量最高的电子,其电子云在空间有①_________个伸展方向,原子轨道呈②__________________形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为: 
该同学所画的电子排布图违背了_________________________。
(4)G位于①_________族②________区,价电子排布式为③______________________。
(5)DE3分子中,中心原子的杂化方式为①_____________,其分子的立体构型为②_____________。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为_____________cm。
针对下面9种元素,完成以下各小题
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅥA |
ⅦA |
O |
|
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)单质为有色气体的元素是___________(填名称)。
(2)③④⑤简单离子的半径由大到小的顺序为_____________(填离子符号)。
(3)元素②的单质的电子式为________________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为_____________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是__________,写出一个能表示二者非金属性强弱关系的化学方程式为:______________。
已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
| A.钝化铁片 | B.检验Ba2+ | C.干燥氨气 | D.干燥氯气 |
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体.L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)含碳量在0.03%~2%之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)K与氨水反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
某不锈钢(主要成分为Fe)样品中含有铝、铜等(其它成分忽略),为了测定该合金中铁的含量,有人设计如下工艺流程: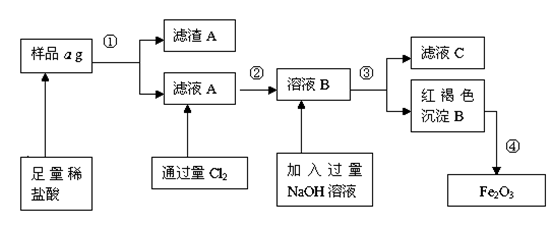
(1)滤液C中溶质含有__(写化学式);
(2)反应②的离子方程式为: ,如何验证滤液A中含Fe2+,而不含Fe3+____ _____。
(3)对所得Fe2O3固体称量得质量为b g,计算该样品中铁元素质量分数的表达式为(用含a、b的式子表示)___ __。