T K时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g) Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
Cl2(g)+CO(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
2 |
4 |
6 |
8 |
| n(Cl2) / mol |
0 |
0.16 |
0.19 |
0. 20 |
0.20 |
下列说法正确的是
A.反应在前2 s 的平均速率v(CO)= 0.080mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2)=" 0.11" mol·L-1,则反应的ΔH<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80%
在核磁共振氢谱中出现两组峰,其氢原子数之比为3︰2的化合物是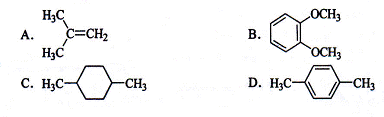
下图表示4—溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是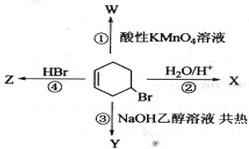
| A.①④ | B.③④ |
| C.②③ | D.①② |
环丙叉环丙烷(A)由于其特殊的电子结构,一直受到结构和理论化学家的注意,由于缺乏有效的合成途径,一度延缓对其反应的研究,直到1993年出现了可以大量制备的方法。根据下列转化,判断下列说法正确的是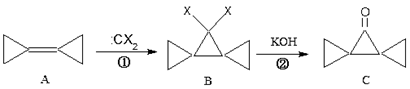
A.A的所有原子都在一个平面内 B.反应①是加成反应
C.反应②是消去反应 D.A的二取代产物只有3种
武兹反应是重要的有机增碳反应,可简单地表示为:2R—X + 2Na →R—R + 2NaX,现用CH3CH2Br和C3H7Br和Na一起反应不可能得到的产物是
| A.CH3CH2CH2CH3 | B.(CH3)2CHCH(CH3)2 |
| C.CH3CH2CH2CH2CH3 | D.(CH3CH2)2CHCH3 |
1840年,俄国化学家盖斯(G·H·Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知每摩单质碳完全燃烧生成CO2放出热量为Y kJ,则1mol C与O2反应生成CO的反应热△H为
| A.-Y kJ/mol | B.-(10X-Y) kJ/mol |
| C.-(5X-0.5Y) kJ/mol | D.+(10X-Y) kJ/mol |