辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下: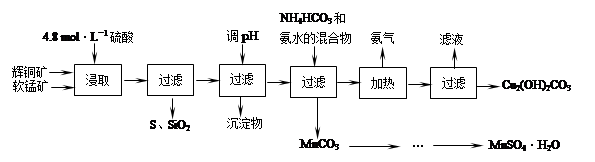
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程式 。
(3)调节浸出液pH的范围为 ,其目的是 。
(4)本工艺中可循环使用的物质是 (写化学式)。
(5)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成 的结果。
(6)用标准BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有 (任写一种)。
实验室制备气体是中学生必做实验,一般地,要得到纯净、干燥气体的装置流程是:发生装置—净化装置—干燥装置---收集装置---尾气处理装置(假设需要)
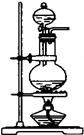
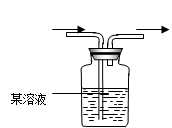
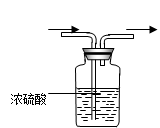
发生装置A发生装置B净化装置C干燥装置D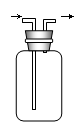
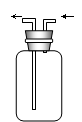
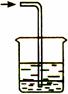
收集装置E收集装置F(可用于收集H2等气体)尾气处理装置G
某研究性化学学习小组现需要若干瓶CO2、O2和Cl2,回答下列问题:
(A)有关发生装置和净化装置
(i) 一般地,依据反应物的状态和反应条件选择所需装置,上述两种发生装置适用于反应物是固体+液体,生成气体的速度可通过操作分液漏斗来控制。
(ii) 如果从发生装置中出来的气体含有杂质(除水蒸汽外),要想得到纯净气体,则必须选择此装置净化,达到除杂的目的。
(1)、 要使生成气体的速度平缓,如何操作分液漏斗使液体顺利流下?_________________。
(2)、若用大理石和稀盐酸制备CO2,因盐酸挥发,使CO2混有HCl杂质,必需选用上述净化装置C除去,装置C中应装___________________溶液。
(3)、若制备O2,反应物是Na2O2和H2O,你选择上述发生装置中的________________,化学方程式是_____________________________________________________。
(4)、若制备Cl2,反应物是MnO2和浓HCl,你选择上述发生装置中的________________,化学方程式是_______________________________________________,想得到纯净、干燥的Cl2是否需要净化装置?为什么?__________________________________________________。
(B)有关收集装置
(i) 不与空气反应,且密度比空气重的气体可用向上排空气法。
(ii) 不与空气反应,且密度比空气轻的气体可用向下排空气法。
(iii) 难溶于水的气体可用排水法。
(5)、上述三种气体可用收集装置中的E装置收集的有________________。
(C)有关尾气处理:对大气产生污染的有毒气体在实验室制备时都要进行尾气处理,
(6)、多余Cl2必须处理,尾气处理装置中盛装的溶液应是____(选填“H2O” 、“NaOH”或 “浓H2SO4”)。
S2C12是一种金黄色易挥发的液体,具有强烈的窒息性,在工业生产上可用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组进行了以下探究。 【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为 76℃、沸点为138℃。
76℃、沸点为138℃。
③ S2C12+C12 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H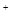 =3C12↑+3H2O请回答下列问题:
=3C12↑+3H2O请回答下列问题: 【实验装置设计】
【实验装置设计】

 (1)B中所放试剂为; C中所放试剂为。
(1)B中所放试剂为; C中所放试剂为。 (2)在加热D时温度不宜过高,其原因是;
(2)在加热D时温度不宜过高,其原因是;
为了提高S2C12的纯度,关键的操作是控制好温度和; (3)G装置的作用是;
(3)G装置的作用是;
(4)写出工业上制漂白粉的化学方程式;
某无色透明溶液可能含有下列离子K+、Al3+、Fe3+、Ba2+、NO3—、SO42—、HCO3—、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
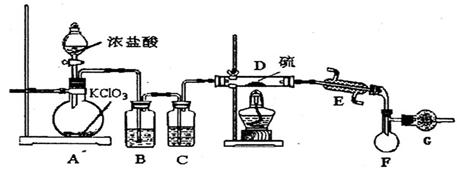
(1)在实验①中,下图所示的操作中正确的是________(填代号)。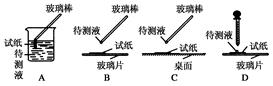
(2)根据上述实验判断原溶液中肯定存在的离子是________,
肯定不存在的离子是________。
(3)写出②实验中产生无色气体的离子方程式:
________________________________________________________________________。
(4)写出③实验中的有关离子方程式:
________________________________________________________________________。
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
| A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
(3)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH 溶液的体积来 |
0.1000mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.28 |
26.28 |
| 第二次 |
25.00 |
1.55 |
30.30 |
28.75 |
| 第三次 |
25.00 |
0.20 |
26.42 |
26.22 |
依据上表中有效数据计算该NaOH溶液的物质的量浓度:c(NaOH)=__________。(保留四位有效数字)
(4)用标准的盐酸滴定上述待测的NaOH溶液时,眼睛要注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由黄色变________色,并且___________________为止。
用脱脂棉包住约0.2g过氧化钠固体粉末,置于石棉网上,然后向包有过氧化钠的位置滴加几滴水,结果脱脂棉剧烈燃烧起来。
试完成下列问题:
(1)写出过氧化钠与水反应的化学方程式
(2)结合脱脂棉剧烈燃烧的实验事实及燃烧的条件可以得出的结论是
(3)某研究性学习小组,为进一步证明上述结论,拟用如图所示的装置进行有关实验。请写出有关的实验操作方法
现象:A处: B处: