常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a
B.0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液: c(HA)>C(Na+)>c(A-)
D.等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:
3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列说法正确的是
| A.如图所示条件下,实验过程中没有热量损失 |
| B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说两次实验放出热量相等 |
| C.图中实验装置缺少环形玻璃搅拌棒 |
| D.烧杯间填满碎纸条的作用是固定小烧杯 |
氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液。电极反应如下:
2H2 +4OH--4e- = 4H2O, O2+2H2O+4e- = 4OH-
据此作出判断,下列说法中错误的是
| A.O2在正极发生还原反应 | B.电池总反应为2H2 + O2 = 2H2O |
| C.反应时负极附近c(OH-)增大 | D.氢氧燃料电池属于环境友好电池 |
原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
| A.C(s)+H2O(g)= CO(g)+H2(g) |
| B.HCl + NaOH = NaCl + H2O |
C.Ca(OH)2+2NH4Cl 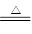 CaCl2 + 2NH3↑ + 2H2O CaCl2 + 2NH3↑ + 2H2O |
| D.CH4(g)+2O2(g)= CO2(g)+2H2O(l) |
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、 c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
| A.c1∶c2=3∶1 | B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率相等 | D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L |
天然存在的金属钫(Fr)极微量。它的21个已知同位素都有放射性。它是碱金属元素中原子序数最大的元素。根据它在周期表中的位置预言其性质,其中不正确的是
| A.在空气中燃烧时生成氧化物Fr2O | B.在已知主族元素中具有最大的原子半径 |
| C.FrOH是极强的碱 | D.钫单质的密度比钠的密度大 |