(l)铝与某些金属氧化物在高温下的反应称为铝热反应,可用于冶炼高熔点金属。
已知:4Al(s)+3O2(g)=2Al2O3(s) 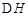 =-2830kJ·mol-1
=-2830kJ·mol-1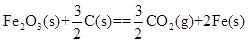
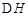 =+230kJ·mol-1
=+230kJ·mol-1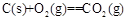
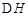 =-390kJ·mol-1
=-390kJ·mol-1
铝与氧化铁发生铝热反应的热化学方程式是 。
(2)如下图所示,各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ;
②装置中Cu电极上的电极反应式为 。
(3)钒(V)及其化合物广泛应用于新能源领域。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。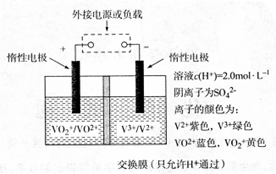
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
请把下列物质按类别填空:
A Na2O B K2SO4 C NaHCO3D镁铝合金
E Na F CaO G CaCO3 H Ca(OH)2
(1)属于盐的是________________________________;
(2)属于碱的是________________________________;
(3)属于单质的是________________________________;
(4)属于氧化物的是________________________________。
在300ml 2mol·L-1 H2SO4溶液中,H+的浓度是______,H+的物质的量是______,SO42-的数目是________。
维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60㎎,微量元素碘约150μg。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变___色。某同学欲探究维生素C的还原性,可选择的试剂是_____(填序号)。
①碘水、淀粉②KI溶液 ③酸性KMnO4溶液
(2)食用加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为____(填序号)。
①I2②KI③KIO3
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验碘盐中的碘酸钾,可观察到的现象是__________。
当前环境污染问题越来越严重,如酸雨、温室效应、臭氧层破坏、有毒物质的污染、汽车尾气的污染、水体污染等已成为世界各国普遍关注和研究的问题。
请回答:
(1)引起温室效应的主要气体是———————————(填序号,下同)。①SO2②CO2
(2)造成居室污染的物质是——————————————。①甲醛②氮气
(3)造成水体污染的原因是——————————————。
①生活污水的任意排放②工业废水的任意排放
(4)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写成该反应的化学方程式:__________________ 。
下列各组物质的分离或提纯,,应选用下述方法的哪一种(填序号)
A分液 B过滤 C萃取D蒸馏 E重结晶F加热分解
(1)从碘水中提取碘____________
(2)用自来水制取蒸馏水____________
(3)分离植物油和水____________
(4)除去溶液中的悬浮的CaCO3____________
(5)除去NaCl中所含少量KNO3___________
(6)除去KCl中少量的 KClO3____________