A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。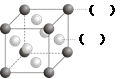
(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
化合物F是一种重要的有机合成中间体,它的合成路线如下: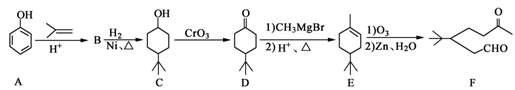
(1)化合物F中含有氧官能团的名称是__________,由B生成C的化学反应类型是_______________;
(2)写出化合物C与乙酸反应生成酯的化学方程式_______________;
(3)写出化合物B的结构简式__________,同时满足下列条件的B的同分异构体(不包括B)共有____种能与FeCl3溶液显紫色,苯环上只有两个取代基;
(4)写出A到B的化学方程式_______________;
(5)某化合物是D的同分异构体,且分子中只有三种不同化学环境的氢.写出该化合物的结构简式___________(写一种)。
【化学—选修5:有机化学基础】
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
已知:(a)
(1)烃A的结构简式是___________;
(2)①的反应条件是___________;②的反应类型是___________;
(3)下列对抗结肠炎药物有效成分可能具有的物质推测正确的是_________;
| A.水溶性比苯酚好,密度比苯酚的大 |
| B.能发生消去反应 |
| C.能发生聚合反应 |
| D.既有酸性又有碱性 |
(4)E与足量NaOH溶液反应的化学方程式是_________;
(5)写出所有符合下列条件的E的同分异构体的结构简式_________;
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
X、Y、Z、W是原子序数依次增大的四种不同主族短周期元素,已知四种元素原子的最外层电子数之和为12,X原子的半径最大,只有W是非金属元素。请回答:
(1)Y元素在周期表中的位置是_________________
(2)四种元素的简单离子中,半径最小的是______离子(填具体的离子符号)
(3)用化学方程式表示工业上获得X单质的方法是________________
(4)Z、W的最高价氧化物对应的水化物恰好反应得到溶液显______性,用离子方程式解释其原因_________
(5)0.1mol/L的X、W组成的化合物溶液中,离子浓度由大到小的顺序为__________
(6)甲是X元素最高价氧化物对应的水化物,将常温下pH=a的甲溶液加热至90℃,其pH值将______(填“增大”“减小”或“不变”)。
常温下,向1Lamol/L的醋酸溶液中加入bg甲固体,反应后溶液呈中性,则醋酸的电离常数Ka=_________(用含a、b字母的代数式表示,体积变化忽略不计)
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
| 元素代号 |
X |
Y |
Z |
M |
Q |
R |
| 原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
0.037 |
| 主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
+1 |
(1)Z在周期表中的位置是_________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是___________(填离子符号)。
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是___________。
(4)Q和R按原子个数比1:1组成的化合物甲,是一种“绿色”氧化剂.
①甲中所含共价键类型是___________。
②空气阴极法电解制备甲的装置如图所示.在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液.图中直流电源的a是_____极,阴极的电极反应式是___________。
对羟基苯甲醛,俗称PHBA,是一种重要的有机化工原料。其结构为 。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:


(1)PHBA的官能团的名称为___________________。
(2)下列有关PHBA的说法正确的是___________________。
| A.PHBA的分子式为C7H6O2 ; | B.PHBA是一种芳香烃; |
| C.1 mol PHBA最多能与4 molH2反应; | D.PHBA能与NaHCO3溶液反应生成CO2 ; |
(3)上述反应中属于取代反应的是____________________。
(4)反应③的化学方程式为___________________。
(5)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为 (只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1∶2;
b.遇FeCl3溶液显示特征颜色;
c.能使溴的四氯化碳溶液褪色;