某天化学兴趣小组听老师讲:"浓硫酸加衣服等于洞洞眼眼,还有刺激性气味产生".兴趣小组结合浓硫酸的性质思考,难道浓硫酸能与碳单质反应?若反应,会生成什么呢?
[查阅资料]:
①
能使澄清石灰水变浑浊
;
②
能使品红溶液褪色,用于检验
存在;
③
能与溴水反应而被吸收
.
[提出猜想]:从物质组成元素看,可能生成
、
、
、
气体及
;
[实验步骤]:实验小组设计了如下步骤:
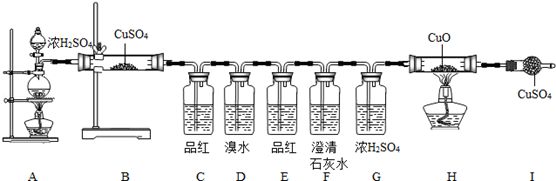
(1)按上述图示安装好仪器;
(2)检查气密性;
(3)加入对应药品,并将浓
放入烧杯中;
(4)加热
,加热
;
(5)停止加热.
[实验分析]:
(1)
处,固体由白色变蓝色,说明有H2O生成;
(2)
处,品红溶液褪色,说明有
(3)
处,品红溶液不褪色,说明
(4)
处,澄清石灰水变浑浊,则产生浑浊的化学方程式为
(5)
、
处无现象,说明无
、
生成.
[实验结论]:
(1)气体中有
和
(2)浓硫酸能与碳单质反应,其化学方程式为
向盛有氢氧化钠溶液的烧杯中滴加稀盐酸,搅拌后没有观察到明显现象.教材上借助酸碱指示剂验证了该反应的发生.是否还有其他方法判断该反应的发生呢?小明和小亮两位同学分别进行了实验探究.
【实验探究一】小明同学取上述反应后的溶液少许于试管中,向其中滴加硝酸银溶液,观察到有白色沉淀生成,再滴加足量的稀硝酸,沉淀不溶解.小明认为白色沉淀是NaCl与AgNO 3反应生成的,于是得出氢氧化钠与盐酸发生了反应的结论.
【实验探究二】小亮同学取一定量的稀盐酸于烧杯中,向其中逐滴加入氢氧化钠溶液,搅拌并用pH计精确测量烧杯中溶液的pH,绘制溶液的pH随时间变化的曲线如图1所示.小亮根据溶液pH的变化,推断盐酸与氢氧化钠发生了反应.

【讨论交流】(1)针对两位同学的实验探究,老师认为小明同学的结论是错误的,理由是 (用化学方程式表示).
(2)在小亮的实验中,当实验进行到10秒时,溶液中含有的溶质是 (填化学式),该溶液能与下列物质发生反应的是 (填序号).
①碳酸钠②氧化铜③硫酸铜 ④镁
(3)从图1的曲线中得知,当实验进行到 秒时,酸与碱恰好完全反应.
【拓展延伸】老师将氢氧化钠溶液逐滴加入到盛有稀盐酸的烧杯中,测定溶液的温度,绘制出溶液的温度随氢氧化钠溶液体积的变化而变化的曲线如图2所示,从能量变化的角度看,该反应属于 反应(填"吸热"、"放热").
【反思评价】有的中和反应没有明显现象,有的中和反应有沉淀生成或固体物质溶解的现象.请写出一个有沉淀生成的中和反应的化学方程式 .
矿物资源的综合利用,可以节约资源与能源.黄铁矿的主要成分为二硫化亚铁(FeS 2),黄铁矿煅烧的化学方程式:4FeS 2+11O 2═2Fe 2O 3+8SO 2.产生的SO 2用于生产硫酸,矿渣(含有少量的硫元素)用于冶铁.
查阅资料:SO 2气体能使品红溶液褪色,能使澄清石灰水变浑浊,反应的化学方程式为SO 2+Ca(OH) 2═CaSO 3↓+H 2O.
(1)FeS 2中硫元素的化合价为 .矿渣在炼铁高炉内反应产生的高炉气含CO、CO 2、SO 2等气体,其中 是形成酸雨的气体.
(2)某化学兴趣小组为检验高炉气中的CO、CO 2、SO 2,设计了如图所示装置(不考虑其他气体对该实验的影响).

①该装置不能检验出的气体是 .
②装置B的作用是 .
③装置E中发生反应的化学方程式为 .
④确认高炉气中含CO的依据是 (填小写字母).
a.装置C中澄清石灰水变浑浊 b.装置C中澄清石灰水不变浑浊
c.装置E中黑色粉末变成红色 d.装置F中澄清石灰水变浑浊
(3)请指出该装置存在的一处明显缺陷 .
(1)实验是科学探究的重要手段,请按要求填写如表。
|
实验内容 |
蒸发结晶 |
稀释浓硫酸 |
|
实验操作 |
|
|
|
问题讨论 |
①当蒸发皿中出现 时,停止加热。 |
②烧杯中物质A的名称是 。 |
(2)如图是实验室制取和收集气体的装置,请按要求回答下列问题。
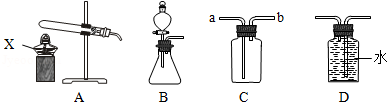
①仪器X的名称是 。
②实验室用高锰酸钾制取并收集较纯净的氧气,应选用的发生装置和收集装置的组合是 __ (填字母),该反应的化学方程式是 。
③实验室收集CO 2时,选用C装置而不选用D装置的理由是 ,CO 2气体应从C装置的 处(填"a"或"b")进入。
碱石灰是由CaO和NaOH固体组成的混合物,它是实验室常用的干燥剂。同学们在实验室里发现一瓶久置的碱石灰样品,为探究其成分,同学们对这包碱石灰样品展开了探究。
【查阅资料】BaCl2溶液显中性。
【提出猜想】该碱石灰样品的主要成分可能含有CaO、NaOH、CaCO3、Na2CO3和 。
【实验探究】
步骤Ⅰ:取部分该碱石灰样品于小烧杯中,加少量水后无放热现象,再继续加足量水,搅拌、静置后有白色沉淀产生。
步骤Ⅱ:取步骤Ⅰ小烧杯内的上层清液少量于试管中,滴加过量BaCl2溶液,有白色沉淀产生。
步骤Ⅲ:将步骤Ⅱ所得物质过滤,向滤液中滴加酚酞溶液,溶液变红色。
【解释与结论】
(1)该碱石灰样品中一定含有的物质是 ,一定不含有的物质是 。
(2)写出步骤Ⅱ中生成白色沉淀的化学方程式: 。
(3)步骤Ⅲ所得溶液中除酚酞外还含有的溶质是 。
【迁移应用】写出不能用碱石灰干燥的两种气体的化学式: 。
现有一包白色粉末,可能含有硫酸钠、碳酸钠、氯化钡、氢氧化钠、硫酸铜中的一种或几种,某化学小组为确定其成分,做了以下探究:
【查阅资料】硫酸钠、氯化钡溶液均呈中性。
(1)步骤Ⅰ:取少量固体于烧杯中,加足量的水,搅拌,过滤,得到白色沉淀和无色滤液。
步骤Ⅱ:取步骤Ⅰ所得的白色沉淀于试管中,加入过量的稀硝酸,沉淀全部溶解,有气泡产生,得到无色澄清透明的溶液。
根据上述两步实验,小组同学认为白色粉末中一定不含有的物质是 ,同时确定了白色粉末中一定含有的物质,并写出了步骤Ⅰ中产生白色沉淀的化学方程式是 。
(2)为了进一步确定白色粉末中可能含有的物质,小组同学利用步骤Ⅰ所得的滤液继续探究。
【讨论猜想】小组同学对滤液中溶质成分做出了多种猜想,其中滤液中含有三种溶质的猜想分别是:
猜想一: ;猜想二: 。
【实验探究】小组同学共同设计如下方案来证明诸多猜想中猜想二成立,请完成下列表格:
|
实验步骤 |
实验现象 |
实验结果 |
|
|
|
猜想二成立 |
【实验结论】小组同学通过以上探究,最终确定了白色粉末的成分。