已知A,B,C,D,E均为初中化学中最常见的化合物,A是氧化物,它是产生温室效应的主要气体;B,C,D,E都由三种元素组成,其中B,D是碱,它们之间存在如图所示的转化关系(反应条件即部分生成物省略):
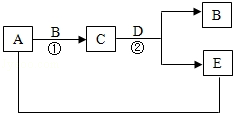
(1)写出化学式:A;B.
(2)反应②的化学方程式为;反应类型属于.
硬水受热后会产生水垢,水垢的主要成分是
和
,其它成分不参与反应。实验室由水垢制取纯净
固体的流程如下: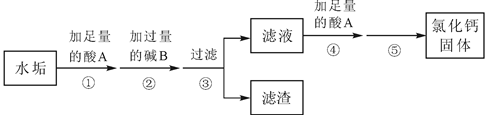
请按要求填空:
(1)酸
是人体胃酸的主要成分,酸
的化学式是;
(2)步骤②中生成沉淀的化学反应方程式是;
(3)步骤④加酸
的作用是;
(4)步骤⑤是利用的方法得到氯化钙固体。
是初中化学常见物质。其中,
的浓溶液能挥发出刺激性气味的气体,从
的反应过程中有蓝色沉淀生成,
为白色沉淀。下图是这些物质的转化关系,部分反应物、生成物及反应条件已省略。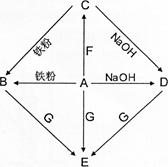
(1)请写出化学式:
,
。
(2)写出
的化学方程式:。
(3)在
的反应过程中,
与
溶液恰好完全反应,反应后所得溶液的
7(填">"、"="或"<")。
(4)
溶液与铁粉反应后,取剩余固体加入盐酸,没有气体放出。请分析:
与铁粉反应后的溶液组成中除了
外,一定存在的物质有,可能存在的物质有。
(7分)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图: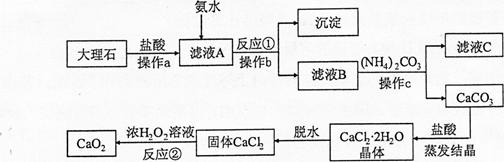
(1)操作a、b、c的名称都是 。
(2)操作a的目的是 。
(3)从滤液C中可回收的副产品的化学式为 。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
(6)在该生产过程中,用110kg大理石制得了72Kg的过氧化钙。如果不考虑过程中的损耗,可计算出大理石中CaCO3的质量分数为 。(结果保留一位小数)
氯化钠是日常生活中的必需品,某氯化钠样品中除含氯化钠外,还含有少量的
以及不溶性杂质.以下是提纯该样品的操作流程图.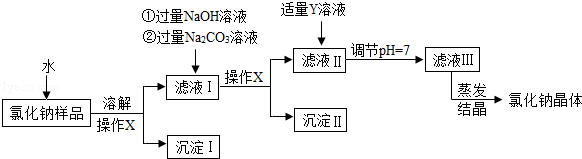
请回答下列问题:
(1)操作
的名称是.
(2)
溶液中溶质的化学式是.
(3)上述操作流程中共发生个复分解反应.
金属和酸、碱、盐的化学性质是初中化学的核心知识,如图,A、B、C、D分别表示上述四类物质中常见的一种,A、B、C、D之间的连线表示它们彼此之间能够发生化学反应,其中A与B能够发生中和反应,D是目前世界上产量最多的金属.
请回答:
(1)C属于(填"酸"、"碱"或"盐").
(2)A与D反应产生气体的化学式是.
(3)实验室可从B和C两类物质中各选一种具体物质作为原料来制取NaOH,写出该反应的化学方程式.