甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是 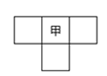
| A.元素甲的简单气态氢化物稳定性比乙的强 |
| B.元素丁在周期表中的位置为第3周期,VIA族 |
| C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
| D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
下列叙述中,错误的是()
| A.原子半径:Na>Mg>O |
| B.13C和14C属于化学性质不同的同位素 |
| C.ⅦA族元素是同周期中非金属性最强的元素 |
| D.N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
化学与工农业生产和人类生活密切相关。下列说法中,不正确的是()
| A.油脂在碱性条件下水解可制得肥皂 | |
B.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
C.人体中缺碘元素会得贫血病 |
| D.研制推广甲醇燃料汽车,有利于“减排目标”的实现 |
高铁酸钾(K2FeO4)和二氧化氯(ClO2)都是高效水处理剂,其工业制备的反应原理分别为 2Fe(OH)3+3 KClO+4KOH=2K2FeO4+3KCl+5H2O
2KClO3+ Na2SO3 +H2SO4=2ClO2 + Na2SO4+ K2SO4+ H2O
下列说法中,正确的是()
| A.上述两个反应中, KClO3做氧化剂,KClO 做还原剂 |
| B.ClO2做水处理剂原理和明矾相同 |
| C.K2FeO4用于杀菌后其还原产物还可用作净水剂 |
| D.制备等物质的量的K2FeO4和ClO2,转移的电子数之比为1 : 1 |
在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O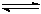 HCO3-+OH-。下列说法中,正确的是()
HCO3-+OH-。下列说法中,正确的是()
A.升高温度,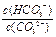 减小 减小 |
B.通入CO2,平衡向正反应方向移动 |
| C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |
若NA代表阿伏加德罗常数,则下列叙述正确的是() 
A.16g氧气和臭氧的混合物中原子的数目0.5NA |
B.1mol Cl2与足量的铁完全反应,转移的电子数为2NA |
C.1 L 0.5mol·L-1AlCl3溶液中含有的Al3+数目为0.5NA |
D.在标准状况下,22.4L HCl与22.4L H2O2所含有的电子数均为18 NA |