工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下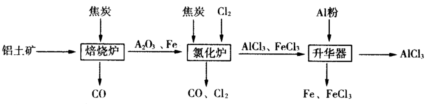
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3。时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为:____________________________。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为_______________。充分反应后温度降至____________以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的____(填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式 ________;与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al):m(Pb)=_________________。
将一定量的碳与8 g O2置于一密闭容器中,使之在高温下反应,当恢复至原温度时,容器内压强比原来增大0.4倍,则参加反应的碳的质量是多少?
高温下用碳还原某金属氧化物MO2,在标准状况下,得到400 mL CO、100 mL CO2和0.978 g金属M,则M的相对原子质量是多少?
已知某浓度氨水中氨气的物质的量浓度为18.4 mol·L-1,溶液的密度为0.900 g·mL-1,则该溶液中溶质的质量分数是多少?
地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6 mg由高岭石〔Al4Si4O10(OH)8〕和方解石(CaCO3)组成的矿物,加热,在673 K~1123 K区间内分解为氧化物,样品总失重为13.8 mg。
(1)方解石的分解率为____________。
(2)计算矿物中高岭石的质量分数。
下面是一个四肽,它可以看作是4个氨基酸缩合生成3个水分子而得。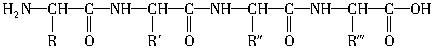 式中,R、R′、R″、
式中,R、R′、R″、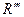 可能是相同的或不同的烃基,或有取代基的烃基,
可能是相同的或不同的烃基,或有取代基的烃基, 称为肽键。今有一个“多肽”,分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:
称为肽键。今有一个“多肽”,分子式是C55H70O19N10,已知将它彻底水解后只得到下列四种氨基酸:

甘氨酸(C2H5NO2)丙氨酸(C3H7NO2)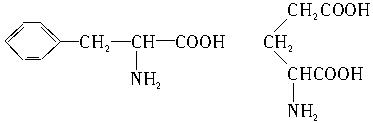
苯丙氨酸(C9H11NO2)谷氨酸(C5H9NO4)
问:(1)这个“多肽”是几肽?
(2)该多肽水解后,有几个谷氨酸?
(3)该多肽水解后,有几个苯丙氨酸?