金属铜的导电性仅次于银,大量用于电气工业。
(1)写出铜的基态原子价电子电子排布式________。
(2)铜的某种氯化物晶体的晶胞结构如右图所示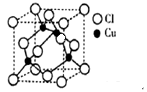 ,该氯化物的化学式为__________。
,该氯化物的化学式为__________。
(3)向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]Cl2晶体。氨分子中N原子的杂化方式为__________。上述深蓝色晶体中含有的化学键除普通共价键外,还有________和_____________。
(4)NH3的沸点比pH3大,其原因是________________________________。
物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)将10.6 g Na2CO3溶于水配成1 L溶液
①该溶液中Na2CO3的物质的量浓度为_______,溶液中Na+的物质的量浓度为________。
②向该溶液中加入一定量NaCl固体,使溶液中Na+的物质的量浓度为0.4 mol·L-1(假设溶液体积不变)需加入NaCl的质量为_____,Cl-的物质的量浓度为_____。
(2)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为。
(3)在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为_______mol。生成1 mol Cu3P时,参加反应的P的物质的量为_______mol。
把5.1g镁铝合金的粉末放入500mL1mol·L-1盐酸中,恰好完全反应。试计算:
(1)该合金中镁和铝的物质的量。
(2)将等质量的该合金投入到足量的氢氧化钠溶液中,求标况下放出气体的体积。
将镁、铝的混合物共0.2mol,溶于200mL4mol·L—1的盐酸溶液中,然后再滴加2mol·L—1的NaOH溶液。请回答下列问题:,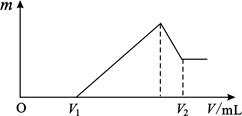
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Mg)=mol;
(2)0~V1段发生的反应的离子方程式为;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+ 刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=mL;
(4)试计算V2的值: V2=mL。
将1.66 g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1 mo1·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有(填化学式)。
(2)当到达B点时,产生CO2的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数。(写出必要计算过程,结果保留3位有效数字)
计算:用32g Cu与足量的浓硫酸反应制取SO2气体,反应方程式为:Cu + 2H2SO4(浓)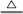 CuSO4 + SO2↑+2H2O
CuSO4 + SO2↑+2H2O
(1)生成的SO2在标准状况下的体积是多少?
(2)该反应中做氧化剂的H2SO4的物质的量为多少?