下列叙述正确的是
| A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉 |
| D.过量的铜与浓硝酸反应,生成的气体只有NO2 |
按糖类的现代定义,下列物质不属于糖类的是( )

实验室进行下列反应时,需用水浴加热的是( )
①石油的分馏 ②合成乙酸乙酯 ③制取乙烯 ④制硝基苯 ⑤蔗糖水解 ⑥葡萄糖溶液的银镜反应 ⑦测定KNO3在80 ℃时的溶解度⑧制溴苯 ⑨乙酸乙酯的水解
| A.④⑤⑥⑦⑨ |
| B.③⑤⑥⑦⑧ |
| C.①②③⑤⑦ |
| D.②③⑤⑥⑦ |
有四种有机物:①纤维素,②环己烷,③苯,④乙酸。取等质量的上述有机物分别在过量氧气中完全燃烧,其耗氧量由大到小排列顺序为( )
| A.①②③④ |
| B.②③①④ |
| C.④①③② |
| D.③④①② |
下列实验事实能用同一原理解释的是( )
| A.SO2、Cl2均能使品红溶液褪色 |
| B.NH4Cl固体、固体碘受热时均能变成气体 |
| C.福尔马林、葡萄糖与新制的Cu(OH)2共热均有红色沉淀生成 |
| D.乙醛、乙烯均能使溴水褪色 |
胱氨酸的结构简式是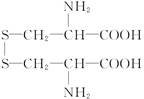 ,下列说法正确的是( )
,下列说法正确的是( )
| A.含硫量大于26% |
| B.不能形成酸式盐 |
C.在强酸性溶液中的存在形式是 |
| D.含氮量大于12% |