某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳(沸点76.80C)为溶剂将碘从碘水中提取出来,具体过程如图所示。
请回答下列问题:
(1)操作①的名称为 、 ;
(2)操作②中用到氯气,请写出实验室制取氯气反应的离子方程式 ;
(3)向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是 ;
(4)操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是 ;
(5)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶外,还需要 ,实验中温度计水银球所处位置为 ,锥形瓶中收集到物质的名称为 。
(9分)有一已磨成粉末的混合物试样,是由下列六种物质中的若干种等量组成:
NaCl 、 KCl 、 CaCl2、CuSO4( 无水)、 Na2SO4、Na2CO3
为了要确定该粉末试样的成分,某研究性学习小组先查了资料后,研拟了一个检验粉末试样的流程图,并在老师的指导下在化学实验室中进行实验。以下是该小组实验报告的一部分﹕
实验一:用烧杯取粉末试样约2克,加蒸馏水约100毫升,搅拌后形成无色的透明溶液X。
实验二:在溶液X中加了盐酸,观察到在溶液中陆续产生气泡,至溶液不再冒气泡,溶液仍为无色透明(贴上卷标Y)。
实验三:在无色透明的溶液Y中,滴加BaCl2溶液,即见白色沉淀。
实验四:继续滴加BaCl2溶液,至白色沉淀不再产生后,过滤分离出白色沉淀,得到透明的无色滤液Z。
实验五:在滤液Z中,滴入AgNO3溶液,则见白色沉淀,加入稀硝酸,沉淀不溶解。
(1)根据上述实验报告,原粉末中一定没有哪两种物质﹖(填化学式)
(2)原粉末中,一定含有哪两种物质﹖ ( 填化学式)
(3)若只需回答上述(1)(2)的问题,你认为该小组同学不需要做哪两个实验(填标号)
a、实验一 b、实验二 c、实验三 d、实验四 e、实验五
(15 分)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:(已知:硅不与盐酸和水反应)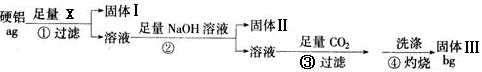
(1)若固体Ⅰ中含有铜和硅,步骤①的试剂X应选择(填“NaOH溶液”“盐酸”“FeCl3溶液”);步骤②的操作是,得到固体Ⅱ反应的离子方程式为
(2)固体Ⅲ的化学式为步骤④反应的化学方程式为
(3)该铝合金中铝的质量分数是________________
(4)步骤④中的沉淀没有用蒸馏水洗涤时,会使测定结果(填“偏高”“偏低”“不影响”)
(8分)按图中所示装置,用两种不同操作分别进行实验.回答有关问题: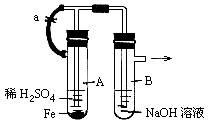
(1)按图示连接好装置,打开止水夹a,在B中可观察到的现象是:________,A中发生反应的化学方程式是;
(2)反应片刻后,夹紧止水夹a,此时可观察到的现象有:________,B中发生反应的离子方程式是:________。
氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。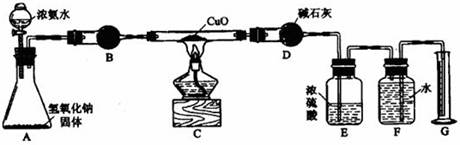
⑴写出氨气与氧化铜反应的化学方程式。
⑵在A的锥形瓶中放入NaOH固体的目的是。
⑶在干燥管B里不能选用的干燥剂是(填序号)。
A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠
⑷在C的玻管中观察到的现象是。
⑸E装置中盛装浓硫酸的目的是。
⑹待实验完毕后,若实验测得N2的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为。(用含a、b字母的代数式表示)
某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。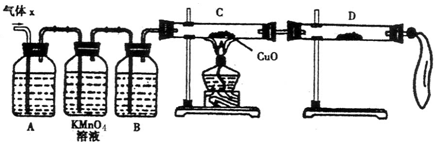
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。