用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,46gNO2含有3NA个原子 |
| B.7.8gNa2O2中含有的阴离子数目为0.2NA |
| C.室温时,1LpH=2的NH4Cl溶液中水电离出H+的数目为10-12NA |
| D.过氧化氢分解制得标准状况下1.12LO2,转移的电子数目为0.2NA |
下列说法不正确的是()
| A.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C.向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解 |
| D.向MgCl2溶液中滴加NaOH溶液,产生白色沉淀,再加入FeCl3溶液,沉淀逐渐变为红褐色 |
下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是()
| A.Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B.NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C.NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D.NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
关于下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④太阳能、氢能和海洋能都属于新能源;⑤置换反应都属于离子反应。其中正确的是()
| A.①②④ | B.①②⑤ | C.②③④ | D.③④⑤ |
下列说法或表达正确的是()
①次氯酸的电子式为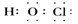
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤C、P、S、Cl的氧化物对应水化物的酸性逐渐增强
A.①③⑤ B.①②④ C.①②③ D.②④⑤
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
下列说法正确的是
| A.气体A是NO2 | B.X中肯定存在Fe2+、A13+、NH4+、SO42― |
| C.溶液E和气体F不能发生化学反应 | D.X中不能确定的离子是A13+和C1― |