用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是
| 选项 |
电极a |
电极b |
A溶液 |
B溶液 |
现象或结论 |
| A |
Cu |
Zn |
CuSO4 |
ZnSO4 |
一段时间后,a增加的质量与b减少的质量相等 |
| B |
Cu |
Zn |
稀H2SO4 |
ZnSO4 |
盐桥中阳离子向b极移动 |
| C |
C |
C |
FeCl3 |
KI、淀粉混 合液 |
b极附近溶液变蓝 |
| D |
Fe |
C |
NaCl |
FeCl3 |
外电路电子转移方向:b→a |
下列反应中符合下图图像的是 ( )。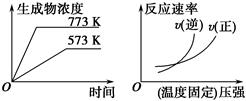
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g)ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g)ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g)ΔH=+Q4 kJ·mol-1(Q4>0) |
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是 ( )。
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
下列各组变化中,ΔH或Q前者小于后者的一组是( )。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
| A.①②③ | B.②④ | C.②③④ | D.③④ |
已知一定条件下断裂1 mol下列化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是 ( )。
| A.2HCl(g)=H2(g)+Cl2(g)的反应热ΔH<0 |
| B.H(g)+Cl(g)=HCl(g) ΔH=+431 kJ·mol-1 |
| C.相同条件下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相等 |
| D.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ |
下列说法或表示方法正确的是 ( )。
| A.反应物的总能量低于生成物的总能量时,反应一定不能自发进行 |
| B.已知:H2S(g)+aO2(g)=x+bH2O(l) ΔH,若ΔH表示H2S的燃烧热,则x为SO2(g) |
| C.已知:2SO2(g)+O2(g)2SO3(g) ΔH=-98.3 kJ·mol-1,在密闭容器中充入1 mol SO2和0.5 mol O2,充分反应后放出49.15 kJ的热量 |
| D.由石墨比金刚石稳定可得:C(s,金刚石)=C(s,石墨) ΔH>0 |