研究碳及其化合物的性质对促进低碳社会的构建具有重要意义。
(1)将不同量的CO(g)和H2O(g)分别通人体积为2L的恒容密闭容器中,进行反应 CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以CO2表示的反应速率为_____________(保留2位小数);
②该反应为___________(填“吸热”或“放热”)反应;
③实验2的平衡常数为___________________________。
(2)已知在常温常压下:
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1451.6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
写出甲醇不完全燃烧生成CO和液态水的热化学方程式_______________________________。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟该过程,其原理是:通电后,Co2+被氧化成Co3+,然后以Co3+做氧化剂把甲醇氧化成CO2而除去(Co3+的还原产物是CO2+)。
①写出阳极电极反应式_______________________________________________________________ ;
②写出除去甲醇的离子方程式__________________________________________________________。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下:
已知:
①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2·2H2O的相对分子质量是244
回答下列问题:
(1)SiCl4发生水解反应的化学方程式为_______________________________________
(2)用H2还原SiCl4蒸汽可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为_____________________________________________
(3)加钡矿粉并调节pH=7的目的是①,②
(4)过滤②后的滤液中Fe3+浓度为(滤液温度25℃,Ksp[Fe(OH)3]=2.2×10-38)
(5)生成滤渣A的离子方程式__________________________________________
(6)列式计算出10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量为多少吨?
碳及其化合物有广泛的用途。
(1)在电化学中,常用碳作电极:
①在酸性锌锰干电池中,碳棒作极。
②若用碳棒和铁棒做电极电解饱和食盐水生产烧碱时,碳棒作极,反应的离子方程式。
(2)将水蒸气通过红热的碳可产生水煤气:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是。
CO(g)+H2(g) △H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是。
| A.升高温度 | B.增加碳的用量 |
| C.加入催化剂 | D.用CO吸收剂除去CO |
(3)将一定量的CO(g)和H2O(g)通过某恒容的密闭容器中,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)得到如下数据:
CO2(g)+H2(g)得到如下数据:
| 温度/℃ |
起始浓度mol/L |
平衡浓度mol/L |
|
| CO(g) |
H2O(g) |
H2(g) |
|
| 900 |
2.0 |
0.8 |
0.4 |
通过计算,该反应的平衡常数为:。
(4)工业上把水煤气中的混合气体处理后,获得较纯的H2用于合成氨:
N2(g)+3H2(g)一定条件下2NH3(g)△H= —92.4kJ/mol某同学在不同实验条件下模拟化工生产进行实验,N2浓度随时间变化如图: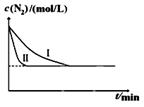
①与实验I比较,实验II改变的条件为:。
②实验III比实验I的温度要高,其它条件相同,请在下图画出实验I和实验III中NH3浓度随时间变化的示意图。
“低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上)
___C+____KMnO4+____H2SO4→___CO2↑+____MnSO4+____K2SO4+___H2O
(2)将不同最的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)得到表中三组数据
CO2(g)+H2(g)得到表中三组数据
| 实验 |
温度℃ |
起始量/mol |
平均量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2)表示的反应速率为____(取二位小数,下同)。
②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可以利用实验____的数据进行,其K=____。
(3)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO(g)△H=-566.0kJ/mol
③H2O(g)=H2O(I)△H=-44.0kJ/mol
写出甲醇(CH2OH)不宪全燃烧生成一氧化碳和液态水的热化学方程式_。
近期,我国个别企业违法排污导致地下
水严重污染又成为媒体焦点。对水的质量监控
有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。
I.对溶解氧(DO)的测定步骤是:
①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+: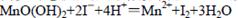
③最后用0.0100 mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2: ,
,
消耗Na2S2O3标准溶液11.00mL。
(1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。
(2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:________。
(3)水样中溶解氧(DO)的浓度为mg·L-1。
II.该实验需用Na2S2O3固体配制100mL 0.0100 mol·L-1Na2S2O3标准溶液。
(4)请按配制的过程填写选用仪器的顺序:____(填编号)。
①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯
(5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。
| A.没有用蒸馏水洗涤烧杯 |
| B.定容时俯视容量瓶刻度线 |
| C.配制前容量瓶洗净后没干燥 |
| D.摇匀后见液面下降,再加水至刻度线 |
E.用天平称量药品时,左盘低,右盘高
Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为。
(2)C中所盛试剂可能是;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO②可能是Cu2O③可能是CuS
学生丙提出假设②一定不成立,依据是;该生用如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为(填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-) 
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式;
②以淀粉为指示剂,则到达滴定终点的现象是;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为。