在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)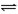 2NH3(g) △H=-92.4 kJ·mol-1)
2NH3(g) △H=-92.4 kJ·mol-1)
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol N2、3 mol H2 |
4 mol NH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
| 气体密度 |
ρ1 |
ρ2 |
| 反应物转化率 |
α1 |
α2 |
下列说法正确的是
A.c1<c2<2 c1 B.a+b>92.4 C.α1 +α2=1 D.ρ2=2ρ1
在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放置在漫散光的地方,两种气体发生反应后恢复到原温度。下列叙述中不正确的是
| A.容器内原子总数不变 |
| B.容器内分子总数不变 |
| C.容器内压强不变 |
| D.反应后得到的产物为混合物 |
下列说法正确的是
| A.活化分子间所发生的碰撞为有效碰撞 |
| B.增大反应物浓度,可增大活化分子的百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子百分数 |
| D.有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
化学与人类生活、能源开发、环境保护、资源利用等密切相关。下列说法正确的是
| A.推广燃煤脱硫技术,可以防治SO2、CO的污染 |
| B.绿色化学的核心是应用化学原理对环境污染进行治理 |
| C.无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| D.垃圾是放错地方的资源,应分类回收利用 |
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为
| A.7:2 | B.5:4 |
| C.3:5 | D.2:7 |
有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3无标签溶液,为鉴别它们,取四支试管分别装入一种溶液,向上述四支试管中分别加入少许剩下的一种溶液A,下列结论错误的是
| A.有三支试管出现沉淀时,则A是AgNO3溶液 |
| B.若全部没有什么现象变化时,则A是NH4NO3溶液 |
| C.一支试管出现气体,两支试管出现沉淀时,则A是HCl溶液 |
| D.若只有两支试管出现沉淀时,则A是BaCl2溶液 |