氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN-可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4- H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含 的废水会发生如下反应:
的废水会发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。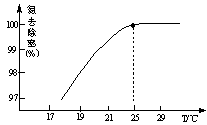
②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
(1)在S+2KNO3+3C=K2S+N2+3CO2的反应中元素被氧化,元素被还原;
是氧化剂,是还原剂;是氧化产物,是还原产物。
(2)某物质A在一定条件下加热分解,产物都是气体,分解方程式为:
2A(s)=" B(g)" + 2C(g) + 2D(g),取一定量的A加热,完全分解,同温同压下测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为。
(3)现有A、B、C、D四瓶溶液,它们分别是NaCl(0.1mol?L-1)、HCl(0.1mol?L-1)、NaOH(0.1mol?L-1)和酚酞试液(0.1%)中的一种。有人不用其他试剂,就可以把它们一一鉴别开来,其实验步骤如下:
①各取溶液少许两两混合,据现象不同分成两组;
②取一组混合液,不断滴入另一组的一种未知溶液,根据现象不同可鉴别出A和B两种溶液;
③再取已鉴别出A溶液2mL, 滴入3滴未知C溶液,再加入D溶液4mL,在这个过程中无明显颜色变化;
综合以上实验可知,A、B、C、D溶液分别是:
A; B; C; D。
常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是:
(2)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法:
(3)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(结合化学方程式说明):
(4)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有人设计如下图所示的装置:
请简述实验操作及原理:
威斯迈尔反应是在富电子芳环上引入甲酰基的有效方法。其过程首先是N,N-二甲基甲酰胺与POCl3反应生成威斯迈尔试剂:
接着威斯迈尔试剂与富电子芳环反应,经水解后在芳环上引入甲酰基。例如: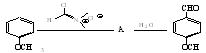
10-1用共振式表示威斯迈尔试剂正离子。
10-2由甲氧基苯转化为对甲氧基苯甲醛的过程中,需经历以下步骤:⑴芳香亲电取代⑵分子内亲核取代⑶亲核加成⑷质子转移⑸消除。画出所有中间体的结构简式。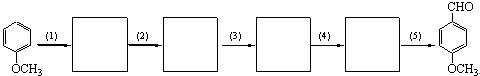
10-3完成下列反应: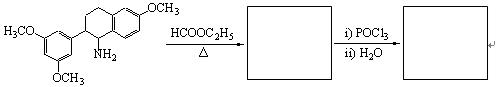
化合物A、B和C的分子式均为C7H8O2。它们分别在催化剂作用和一定反应条件下加足量的氢,均生成化合物D(C7H12O2)。D在NaOH溶液中加热反应后在酸化生成E(C6H10O2)和F(CH4O)。
A能发生如下转化: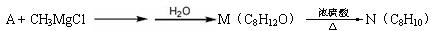
生成物N分子中只有3种不同化学环境的氢,它们的数目比为1∶1∶3。
9-1 画出化合物A、B、C、D、E、M和N的结构简式。
9-2 A、B和C互为哪种异构体?(在正确选项的标号前打钩)
①碳架异构体②位置异构体③官能团异构体④顺反异构体
9-3 A能自发转化为B和C,为什么?
9-4 B和C在室温下反应可得到一组旋光异构体L,每个旋光异构体中有个不对称碳原子。
化合物B是以β-紫罗兰酮为起始原料制备维生素A的中间体。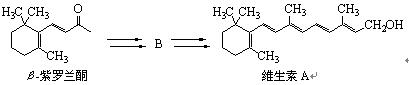
由β-紫罗兰酮生成B的过程如下所示: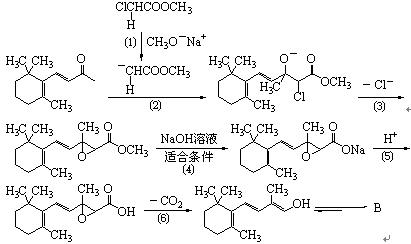
8-1 维生素A分子的不饱和度为。
8-2 芳香化合物C是β-紫罗兰酮的同分异构体,C经催化氢解生成芳香化合物D,D的1H NMR图谱中只有一个单峰。画出C的结构简式。
8-3 画出中间体B的结构简式。
8-4 以上由β-紫罗兰酮合成中间体B的过程中,⑵、⑶、⑷、⑹步反应分别属于什么反应类型(反应类型表述须具体,例如取代反应必须指明是亲电取代、亲核取代还是自由基取代)。