钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下: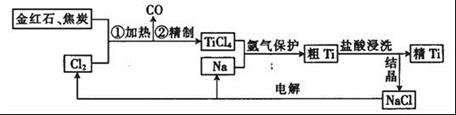
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
从粗TiCl4中精制TiCl4的方法是________(填字母)。
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:_________________;阴极产物是__________。
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
(4)如图是一个制取氯气并以氯气为原料进行反应的装置,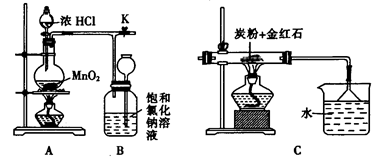
①装置A中发生反应的化学方程式为_____________________________________。
②在实验室中,某同学欲用如图所示装置净化氯气,则M、N中应盛放的试剂分别是__________、__________。(填试剂名称)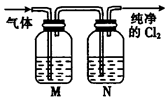
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯。Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体。试写出装置C中发生反应的化学方程式:_________________________。
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2•xMgCO3]
(2)为了确定产物,进行以下定性实验:
| 实验序号 |
实验 |
实验现象 |
结论 |
| 实验Ⅱ |
将实验I中收集到的气体点燃 |
安静燃烧, 火焰呈淡蓝色 |
气体成分为 ① |
| 实验Ⅲ |
将实验I中的白色不溶物滤出、洗涤,取少量加入足量② |
③ |
白色不溶物中含有MgCO3 |
| 实验Ⅳ |
取实验Ⅲ中的滤液,向其中加入适 量 ④ 稀溶液 |
产生白色沉淀,溶液红色变浅 |
溶液中存在CO32- 离子 |
实验Ⅲ中洗涤的操作方法是。
(3)为进一步确定实验I的白色不溶物的成分,进行以下定量实验,装置如图所示:
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
装置C的作用是;
白色不溶物的化学式为 。
(4)写出镁与饱和碳酸氢钠溶液反应的化学方程式。
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应。
(1)取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是___________________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为。
研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
方案一:检验溶液中含有Fe2+证明发生了氧化还原反应
方案二:检验溶液中含有证明发生了氧化还原反应
实验用品:0.1mol/L BaCl2、3mol/L盐酸、0.1mol/LKMnO4(H+)、氯水、20%KSCN、0.5mol/LKI;试管若干、胶头滴管若干
Ⅰ预处理:将(1)中获得的混合物放在如图装置中处理足够时间。
Ⅱ检验过程
| 操作 |
现象及结论 |
| 基于方案一: |
|
| 基于方案二: |
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为________;仪器b中可选择的试剂为________;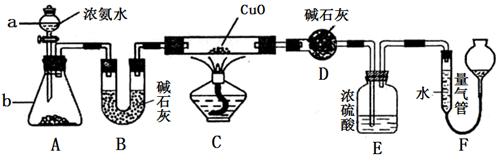
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是()
| A.Cl2与饱和食盐水 | B.CO2 与40%的NaOH溶液 |
| C.NH3与饱和食盐水 | D.HCl与水 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有还原性,写出相应的化学方程式______________________________ .
(4)E装置中浓硫酸的作用_______________________
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
I.下面是提纯大理石(主要杂质是氧化铁)的流程图:
按要求回答下列问题:
(1)操作Ⅱ中要随时测定pH,在实验室中用pH试纸测定溶液pH的操作是______________________________。
(2)检验Fe3+已完全生成Fe(OH)3沉淀的方法是________________________________。
(3)由滤液B得到晶体B,其主要成分是__________。
II.某化学小组在实验中用浓硝酸和铜反应制取二氧化氮并探究二氧化氮是否能支持木炭的燃烧,其实验装置图如下:
(1)按气流方向连接各仪器接口,顺序为a→______→______→______→______→f。装置C的作用________________、装置D的试剂是__________________。
(2)已知二氧化氮和碳在点燃条件下反应生成两种物质的量比为2:1的无毒气体,则该反应的化学方程式为:___________________________。
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题: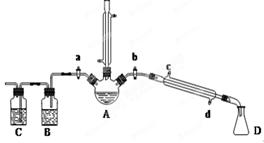
(1)仪器D的名称是。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是、。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 |
熔点/0C |
沸点/0C |
| 1-丁醇 |
-89.5 |
117.3 |
| 1-溴丁烷 |
-112.4 |
101.6 |
| 丁醚 |
-95.3 |
142.4 |
| 1-丁烯 |
-185.3 |
-6.5 |
为了进一步精制1-溴丁烷,继续进行了如下实验:待烧瓶冷却后,拔去竖直的冷凝管,塞上带温度计的橡皮塞,关闭a,打开b,接通冷凝管的冷凝水,使冷水从(填c或d)处流入,迅速升高温度至℃,收集所得馏分。
(6)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是。