2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致
发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8一羟基喹啉铝等。
(1)Mn2+在基态时,核外电子排布式为_________。
(2)硫化锌的晶胞结构如图1所示,则每个晶胞中含S2-的数目为________个。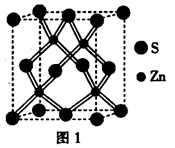
(3)蒽(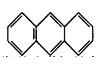 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。
(4)8一羟基喹啉铝具有较高的发光效率。8一羟基喹啉铝的分子结构如图2所示,其分子中存在的相互作用力有_______(填字母)。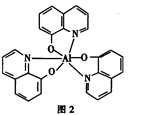
A.极性键 B.非极性键 C.金属键 D.氢键 E.配位键
(5)已知铜元素能形成多种化合物。
①CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图3所示。下列说法正确的是________(填字母)。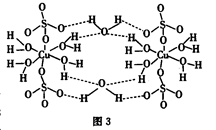
A.在上述结构示意图中,所有氧原子都采用SP3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCO-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95。已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为—2价、Cu为+2价和+3价。则该化合物中+2价Cu和+3价Cu的原子个数之比为_______。
某些有机化合物之间具有如下转化关系: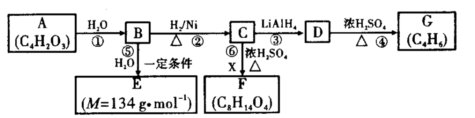
其中:A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种不同化学环境的氢原子,且峰面积之比为2:2:3;G是合成顺丁橡胶的主要原料。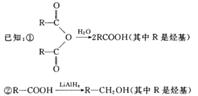
(1)A的结构简式是。
(2)B中所含官能团的名称是。
(3)写出反应类型:③,④
(4)⑥的化学方程式为
(5)E在一定条件下能够发生缩聚反应,写出链节是由四个原子组成的高聚物的结构简式。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构简式可能有种。
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
| 元素 |
有关性质或结构信息 |
| A |
负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B |
B原子得到一个电子后3p轨道全充满 |
| C |
C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D |
D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E |
E元素的核电荷数等于A原子和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B)I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈(填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性(填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:。写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。DBP是增塑剂的一种,可由下列路线合成。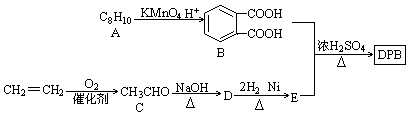
已知以下信息:
①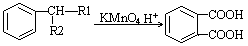
②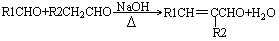
(—R1、一R2表示氢原子或烃基)
(1)A的结构简式,D→E的反应类型。
(2)B的名称是,D中含有的官能团名称是。
(3)由B和E合成DBP的化学方程式。
(4)写出同时符合下列条件的B的所有同分异构体结构简式
①能和NaHCO3溶液反应生成CO2③能使FeC13溶液发生显色反应
②能发生银镜反应④苯环上含碳基团处于对位
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y |
单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z |
Z的一种核素质量数为27,中子数为14 |
| W |
最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第周期第族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的(填“大”或“小”),X的单质分子中σ键和π键的数目比为,Y氧化物属于晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s)△H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s)△H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是。
衣康酸H是制备高效除臭剂,粘合剂等多种精细化工的重要原料,可经下列反应路线得到(部分反应条件略)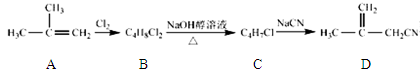
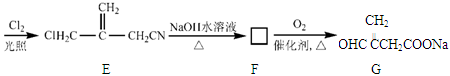
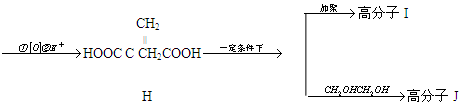
已知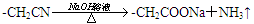
(1) C→D的反应类型是,B→C所加的试剂是,H→I发生反应的官能团的名称叫
(2) J的结构简式为
(3) H不能发生的化学反应是(选填序号)
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(4) E→F反应的化学方程式
(5) H的同分异物体M具有如下的性质:①M不能使溴的CCl4溶液褪色;②1 molM 最多可以与2mol NaOH反应;③1 mol M与足量的NaHCO3反应可生成1mol CO2,则M的结构简式为(写出一种)