酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX—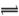 X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显 (填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度 (填“<”、“>”或“=”)0.11 mol·L—1,理由是 。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是  (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是 ,醋酸溶液的物质的量浓度 (填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显 (填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
X+ PbO2+ H2SO4 = Pb(MnO4)2+ PbSO4+ H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是
。请将上述化学方程式配平,把系数填在各物质前的横线上。.
把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后,再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。求:
(1)盐酸的体积 (2)a的取值范围 (3)n(Mg2+)的取值范围
(4)当a值为30时,b值________________。
现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和 Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
在标准状况下进行下列实验:甲、乙、丙各取100mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
| 实验序号 |
甲 |
乙 |
丙 |
| 合金质量 |
0.390g |
0.702g |
0.936g |
| 气体体积 |
448mL |
672mL |
672mL |
分析上表数据后计算:
(1)盐酸的物质的量浓度
(2)合金中镁与铝的物质的量之比
(3)在实验甲反应后溶液中加入过量 0. 2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
2mol·L-1的NaOH溶液,欲使生成的沉淀最少,至少应加入多少毫升0.2mol·L-1的NaOH溶液?
在常压和500℃时把O2和SO2按1∶2 体积比混合,如果混合前O2有10 mol,
平衡时SO3占总体积的91% ,求:
(1)平衡时有多少摩O2转化?
(2)平衡时混合气中SO2的体积分数。
(3)SO2的转化率。
(4)若保持与前相同的条件,改用20molSO3代替O2和SO2,则达平衡时O2的体积分数为多少?
将Mg、Zn混合物2.19g溶于200mL5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计)。求:
(1)反应消耗HCl的物质的量。
(2)该混合物中Mg、Zn的物质的量。