现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和 Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 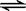 4NO2(g)+ O2(g)。
4NO2(g)+ O2(g)。
反应5min后,测得N2O5转化率为20%,求:
(1)υ(NO2)、υ(O2)分别为多少?
(2)5min时,N2O5占混合气体总体积的百分比是多少?
常温下,将0.05mol/L盐酸溶液和未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的pH=12。用上述NaOH溶液13 ml和pH=3的某一元弱酸HA溶液20ml恰好完全反应生成NaA。试求:
(1)NaOH溶液的物质的量浓度
(2)此一元弱酸的物质的量浓度
(3)求此条件下该一元弱酸的电离平衡常数
向8 g二价金属的氧化物固体中加入稀H2SO4,使其恰好完全溶解,已知所消耗的硫酸体积为100 mL,在所得溶液中插入铂电极进行电解,通电一段时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1)根据计算确定金属氧化物的名称。
(2)计算通电后硫酸溶液的物质的量浓度(假设溶液体积不变)。
(1)常温下100mL0.05 mol·L-1的氢氧化钡溶液中滴加硫酸钠溶液,当两者恰好完全反应时,测得溶液的pH为12。则加入硫酸钠溶液的体积是____________ ml。(溶液混合时体积的变化不计,下同)
(2)常温下,若100体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的PH(用a表示)与强碱的PH(用b表示)之间应满足的关系是。
(3)已知100℃ KW=1×10-12 ,0.1mol/LNaOH溶液,由水电离出的OH-物质的量的浓度为,PH=。
将22.4g铜与100mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为6.72L,请回答:
(1)NO和NO2的体积各为多少?
(2)将盛有所得上述混合气体的容器倒扣在水中,通入标准状况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是多少?