已知: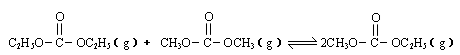 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[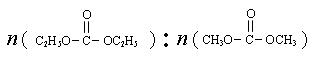 ]分别为3︰1和1︰1、反应物的总物质的量相同时,
]分别为3︰1和1︰1、反应物的总物质的量相同时, 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是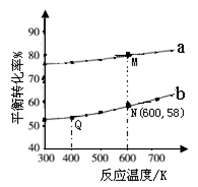
| A.曲线b所对应的投料比为3︰1 |
| B.M点对应的平衡常数小于Q点 |
| C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58 |
| D.M点和Q点对应的平衡混合气体的总物质的量之比为2︰1 |
将过量的CO2通入下列溶液中,出现浑浊的是
| A.饱和碳酸钠溶液 | B.澄清石灰水 | C.漂白粉溶液 | D.CaCl2溶液 |
下图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙,下面四组选项中,符合图示要求的是()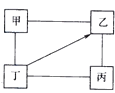
| 甲 |
乙 |
丙 |
丁 |
|
| A. |
H2SO4 |
Na2SO4 |
NaOH |
NaCl |
| B. |
KCl |
K2CO3 |
KOH |
HCl |
| C. |
O2 |
CO2 |
CuO |
C |
| D. |
Fe |
CuCl2 |
Zn |
HCl |
在标准状况下,将aLNH3完全溶于1L水得到VmL氨水,溶液的密度为ρg∙cm-3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是
① ②
② ③
③ ④
④ ⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
⑤上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
| A.①②④ | B.②③④ | C.②④ | D.②③⑤ |
下列叙述中错误的是(用NA代表阿伏加德罗常数的值)
①46gNO2和N2O4的混合气体中含N原子总数为NA ;②用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA;③7.8gNa2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023;④标准状况下,22.4LH2O含有的分子数为NA;⑤等物质的量的NH4+和OH-含电子数均为10NA
| A.①②③④⑤ | B.①③④⑤ | C.②③④⑤ | D.③④⑤ |
把aL含硫酸铵和硝酸铵的混合液分成两等份,一份需用bmol烧碱刚好把氨全部赶出,另一份与氯化钡溶液反应时,消耗cmol氯化钡,由此可知原溶液中NO3-的物质的量浓度是(单位:mol•L-1)()
A. |
B.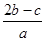 |
C.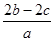 |
D.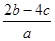 |