铅蓄电池是最常见的二次电池,其构造示意图如下。发生反应的化学方程式为:
Pb(s) + PbO2(s) + 2H2SO4(aq)  2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)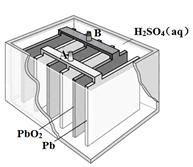
下列说法不正确的是
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
下图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.
后,使c、d两点短路.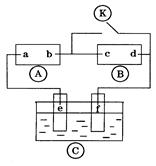
下列叙述正确的是
| A.a为直流电源的负极 |
| B.d极发生的反应为2H++2e-=H2↑ |
| C.f电极为铜板 |
| D.e极发生的反应为Cu-2e- =Cu2+ |
控制适合的条件,将反应2Fe3++2I-==2Fe2++I2,设计成如下图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);△H=-akJ·mo1-1在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=-akJ·mo1-1在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
| A.4 mo1SO2和2mol O2 |
| B.4mol SO2、2mo1 O2和2mol SO3 |
| C.4mol SO2.和4 mo1 O2 |
| D.6mo1 SO2和4 mo1 O2 |
在恒温条件下,体积固定的密闭容器中,进行可逆反应A(s)+3B(g) 3C(g),下列不能说明可逆反应达到平衡状态的是
3C(g),下列不能说明可逆反应达到平衡状态的是
| A.B的浓度不再变化 |
| B.混合气体的压强不再变化 |
| C.混合气体的密度不再变化 |
| D.混合气体的平均相对分子质量不再改变 |
已知:C(s)+H2O(g) CO(g)+H2(g)ΔH =" +130" kJ·mol-1
CO(g)+H2(g)ΔH =" +130" kJ·mol-1
2C(s)+O2(g) 2CO(g)ΔH="a" kJ·mol-1
2CO(g)ΔH="a" kJ·mol-1
H—H、O O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
| A.-332 | B.-118 | C.-220 | D.+350 |