硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下: 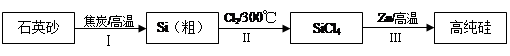
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是 。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是 。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应1: 400℃~756℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是 。
③ 已知Zn(l)=Zn(g) ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
现有四瓶溶液,分别是H2SO4、BaCl2、Na2SO4、Na2CO3中的一种,根据以下实验,请分别确认A、B、C、D各是什么 物质?
物质?
① A加入B中无反应;② A加入C中有气体产生;③ D加入A中有沉淀产生。则:
(1) A:________; B:________;C:_________;D:___________。
A:________; B:________;C:_________;D:___________。
(2)写出A与C、A与D反应的离子方程式。________________________;
___________________。
无机化合物可根据其组成和性质进行分类:
|


 。
。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
氢化物 |
| 化学式 |
① HCl ② |
③ ④ Ba(OH)2 |
⑤ Na2CO3 ⑥ |
⑦ CO2 ⑧ Na2O |
⑨ NH3 ⑩ H2O |
(3)写出⑦转化为⑤的化学方程式: 。
。
(4)写出①与③反应的离子方程式: 。
(5) 写出②与⑧反应的离子方程式: 。
写出②与⑧反应的离子方程式: 。
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶 于1L水中(不考虑反应),其溶液中溶质的质量分数为_______。
于1L水中(不考虑反应),其溶液中溶质的质量分数为_______。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol·L-1。
某校化学实验兴趣小组在“探究溴水与氯化亚铁溶液反应”的实验中发现:在足量的稀氯化亚铁溶液中,加入1—2滴溴水,振荡后溶液呈黄色。查阅资料显示:溴水是溴(Br2)的水溶液,呈黄色;溴水中含有溴单质。
⑴提出问题:Fe3+、Br2,谁的氧化性更强。
⑵猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含(填化学式,下同)所致
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含所致。
⑶设计 实验并验证
实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
除氯 化亚铁溶液和溴水外,还有供选用的试剂:
化亚铁溶液和溴水外,还有供选用的试剂:
a、酚酞试液;b、CCl4;c、无水酒精;d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
⑷结论:氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1— 2滴溴水,溶液呈黄色所发生的离子反应方程式为
2滴溴水,溶液呈黄色所发生的离子反应方程式为
⑸实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是(填离子的化学式)。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为。
以海水中常见物质A为原料可以发展很多工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题。
(1) C和D、C和G反应都可以制取消毒剂。C和D反应制取的消毒剂中有效成分的化学式为______ ____。
(2) 电解A溶液反应的离子方程式为________________________________。
(3) 将F和J通入A的饱和溶液中,反应的化学方程式为:
________________________________。
(4) J的空间构型为___________形。
(5)实验室可利用K与G制取J,请写出该反应化学方程式:______________________________________________________。