某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| |
实验操作 |
实验现象 |
| I |
打开活塞a,滴加氯水,关闭活塞a |
A中溶液变为红棕色。 |
| II |
吹入热空气 |
A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III |
停止吹入空气,打开活塞b,逐滴加入H2O2溶液 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
请回答下列问题:
(1)A中反应的离子方程式是 。
(2)实验操作II吹入热空气的目的是 。
(3)装置C的作用是 ,C中盛放的药品是 。
(4)实验操作III,混合液逐渐变成红棕色,其对应的离子方程式 。
(5)由上述实验得出的结论是 。
(6)实验反思:
①有同学认为实验操作II吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是 。
②实验操作III,开始时颜色无明显变化的原因是(写出一条即可):
。
广泛存在于自然界,是一种重要的化工原料。大理石主要成分为
,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备
气体。下列装置可用于
气体的提纯和干燥。
完成下列填空:
1)用浓盐酸配制1:1(体积比)的稀盐酸(约6
),应选用的仪器是。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
2)上述装置中,A是溶液,
溶液可以吸收_。
3)上述装置中,b物质是。用这个实验得到的气体测定
的分子量,如果B物质失效,测定结果(填"偏高"、"偏低"或"不受影响")。
4)一次性饭盒中石蜡(高级烷烃)和
在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d 正已烷
5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出后溶出。
6)上述测定实验中,连续,说明样品已经恒重。
请设计CO2在高温下与木炭反应生成CO的实验。
(1)在下面方框中,A表示有长颈漏斗和锥形瓶组成的气体发生器,请在答题卡上的A后完成该反应的实验装置示意图(夹持装置,连接胶管及尾气处理不分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、C……;其他可选用的仪器(数量不限)简易表示如下:
(2)根据方框中的装置图,在答题卡上填写该表
| 仪器符号 |
仪器中所加物质 |
作用 |
| A |
石灰石、稀盐酸 |
石灰石与盐酸生成CO2 |
(3)有人对气体发生器作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中。改进后的优点是 ;
(4)验证CO的方法是 。
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
某科研小组用
和浓盐酸制备
时,利用刚吸收过少量
的
溶液对其发扬进行吸收处理。
(1)请完成
与过量
溶液反应的化学方程式:
+2
=。
(2)反应
中的还原剂为。
(3)吸收尾气一段时间后,吸收液(强碱性)肯定存在
和
。请设计实验,探究该吸收液中可能存在的其它离子(不考虑空气的
的影响)
①提出合理假设
假设1:只存在

假设2:既不存在 也不存在
假设3:
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3
、1
、0.01
、淀粉-
溶液、紫色石蕊试液.
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3
至溶液呈酸性,然后将所得溶液分置于
试管中 |
 |
| 步骤2: |
|
| 步骤3: |
高纯
是制备高性能磁性材料的主要原料。实验室以
为原料制备少量高纯
的操作步骤如下:
(1)制备
溶液:
在烧瓶中(装置见上图)加入一定量
和水,搅拌,通入
和
混合气体,反应3
。停止通入
,继续反应片刻,过滤(已知
)。
①石灰乳参与反应的化学方程式为。
②反应过程中,为使
尽可能转化完全,在通入
和
比例一定、不改变固液投料的条件下,可采取的合理措施有、。
③若实验中将
换成空气,测得反应液中
、
的浓度随反应时间t变化如下图。导致溶液中
、
浓度变化产生明显差异的原因是。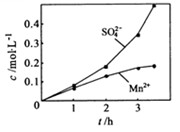
(2)制备高纯
固体:已知
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
开始沉淀时
。请补充由(1)制得的
溶液制备高纯
的操作步骤[实验中可选用的试剂:
、
、
、
]。
①;②;③;④;⑤低于100℃干燥。