工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示: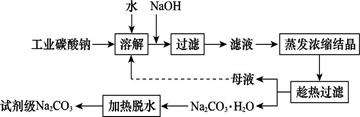
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: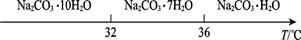
Ⅱ.有关物质的溶度积如下
| 物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为 。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)= 。
(2)“母液”中除了含有Na+、CO32—外,还含有 等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行: (填“可行”或“不可行”),并说明理由: 。
(4)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g)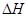 ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g)
Na2CO3·H2O(s)+9H2O(g) 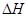 ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式: 。
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3。试回答下列问题:
(1)写出下列元素符号:A,C,D,E。
(2)用电子式表示B和F形成化合物的过程:。
(3)写出A、C、F三种元素最高价氧化物对应的水化物相互反应的化学方程式:
、、。
某有机物A既能使溴水褪色,又能与碳酸钠溶液反应放出CO2,A与CnH2n+1OH反应生成分子式为Cn+3H2n+4O2的酯。回答以下问题:
(1)A的分子式为,结构简式为。
(2)已知含碳碳双键的有机物与卤代氢发生加成反应,卤代氢中的氢原子加到氢原子较多的不饱和碳原子上,而卤原子加到含氢原子较少的不饱和碳原子上,依此规则,A与HBr发生加成反应,生成物B的结构简式为。
(3)B与NaOH溶液发生取代反应后,再用盐酸酸化所生成C的结构简为: ,则C在浓硫酸的作用下,发生分子间脱水生成链状酯的化学方
,则C在浓硫酸的作用下,发生分子间脱水生成链状酯的化学方
程式为。
(4)C在浓硫酸作用下,生成的环状酯的结构简式为。
(5)写出一个与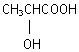 有相同官能团的同分异构体。
有相同官能团的同分异构体。
有一种不饱和醇,其结构简式为CH2==CHCH2OH,请回答下列问题:
(1)写出该化合物中官能团的名称:。
(2)推测该化合物可能发生的反应有(填序号)。
①与酸性高锰酸钾溶液反应②与溴水反应③与H2反应④与Na反应
⑤燃烧反应⑥催化氧化反应
(3)下列物质与CH2==CHCH2OH互为同分异构体的是(填序号)。
| A.CH3CH2OH | B.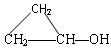 |
| C.CH3CH==CHCH2OH | D.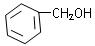 |
信息I: 有机物的转化存在以下计量关系: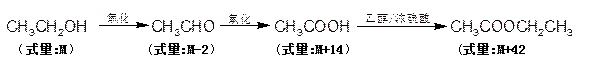

信息II: 芳香族有机物A、B、C、D、E、F之间存在如下转化关系: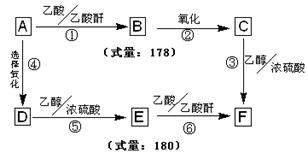
其中:有机物D不能使FeCl3溶液显紫色,它在浓硫酸作用下发生分子内脱水,可形成具有五元环状结构的有机物G。根据上述信息,完成下列问题:
(1)有机物A的分子式为:;
(2)上述①~⑥转化关系中,属于取代反应的是: (填序号);
(3)请写出G的结构简式:;
(4)A的一种芳香族类同分异构体H能与NaHCO3反应,则H共有种结构;
(5)写出反应①的化学方程式:。
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下各有机物间有如下转化关系:(无机物已略去,部分反应的条件未标明。)
(1)J中所含的含氧官能团的名称为____________________。
(2)E与H发生反应的化学方程式是:;
反应类型是。
(3)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是。
(4)已知J有多种同分异构体,写出一种符合下列条件的J的同分异构体的结构简式。
①与FeCl3溶液作用显紫色;
②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种。